Клинические испытания лекарственных средств в Украине
Яблучанский Н.И.
главный редактор газеты "Medicus Amicus"
С обретением Украиной независимости и созданием необходимого правового поля получил интенсивное развитие рынок клинических испытаний лекарственных средств.
Этот рынок является очень перспективным благодаря высокой квалификации украинских врачей, непрерывно увеличивающемуся числу сертифицированных исследователей и открытому доступу к большому числу амбулаторных и стационарных пациентов с самой
разной нозологией.
Как результат, он интенсивно развивается, и ежегодный рост в последние 5 лет составил в среднем 30%. Столь же быстро увеличивается и число утвержденных баз клинических исследований лекарственных средств.
Клинические испытания лекарственных средств проводятся контрактными исследовательскими организациями, а также представительствами фармацевтических компаний, число которых на начало 2006 г. в стране равняется, соответственно, 33 и 11.
С момента вступления в силу Закона Украины "О лекарственных средствах" (1996 г.) прошло 10 лет, поэтому, можно считать, нынешний год является юбилейным для этого молодого и весьма динамичного рынка.
24-25 марта в Киеве состоялась международная конференция "Клинические исследования 2006" (далее "Конференция"), на которой были подведены итоги в области клинических испытаний лекарственных средств в Украине и определены задачи на будущее.
Конференция была проведена в формате обучающего тренинга, что дало возможность ее участникам получить системные представления о клинических испытаниях, от нормативно-правовых до этических включительно.
Тем, кто интересуется данной проблемой, "Medicus Amicus" рекомендует ознакомиться с озвученной на
Конференции в выступлениях директора ГП "Государственный фармакологический центр" МЗ Украины Виктора Чумака, его заместителя Виктора Лизогуба, ведущего научного сотрудника отдела аттестации и инспекции клинических баз Людмилы Ковтун и заведующего отделением фармаконадзора Алексея Викторова
нормативно-правовой базой клинических испытаний лекарственных средств и их экспертизы в Украине. Эта база на сегодня приведена в соответствие с европейскими требованиями и основывается на приводимых ниже основных регулирующих документах, которые для удобства сопровождаются ссылками на Интернет-ресурсы:
1) Закон Украины "О лекарственных средствах" (1996 г., см.: http://www.pharma-center.kiev.ua/zakon_lzu.html )
2) Постановление Кабинета Министров Украины "Об утверждении порядка государственной регистрации (перерегистрации) лекарственных средств и размеров сбора за их государственную регистрацию (перерегистрацию)" (№376 от 26.05.2005 г., см.: http://www.pharma-center.kiev.ua/files/postanova_376.pdf )
3) Приказы Министерства здравоохранения Украины:
a. "О порядке проведения экспертизы регистрационных материалов на лекарственные средства, которые подаются на государственную регистрацию (перерегистрацию), а также экспертизы материалов для внесения изменений в регистрационные документы в период действия регистрационного свидетельства" (№426 от 26.08.2005 г., см.: http://www.pharma-center.kiev.ua/files/nakaz_426.html )
b. "Об утверждении Порядка проведения клинических испытаний лекарственных средств, экспертизы материалов клинических испытаний и Типового положения про комиссию по вопросам этики" (№66, 13.02.2006 г., см.: http://zakon.rada.gov.ua/cgi-bin/laws/main.cgi) Приказ вступил в действие 31 марта текущего года. В основу Приказа положены Директивы Совета Европейского Парламента и Совета 2001/20 ЕС, 2001/83/EC (см.: http://www.innopharm.ru/rus/docs/Directive%20of%20European%20Parliament%20and%20Councel%202001.20.EC.pdf и http://pharmacos.eudra.org/F2/eudralex/vol-1/CONSOL_2004/Human%20Code.pdf ).
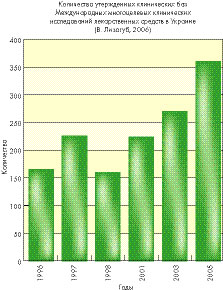
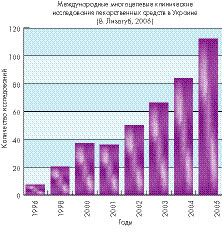
Полезно назвать Руководства Европейского Союза, которые можно найти по ссылке http://eudravigilance.emea.eu.int/human/euPoliciesAndDocs.asp :
1) Детальное руководство к требованиям компетентных
органов по разрешению проведения клинических испытаний медицинских продуктов для использования человеком, извещению о существенных изменениях и заявлению о прекращении испытания (Detailed guidance for the request for authorization of a clinical trial on a medicinal product for human use to the competent authorities, notification of substantial amendments and declaration of the end of the trial).
2) Детальное руководство по сбору, верификации и сообщению об отчетах о неблагоприятных реакциях, возникших во время клинических испытаний медицинских продуктов (Detailed guidance on the collection, verification and presentation of adverse reaction reports arising from clinical trials on medicinal products).
Хельсинская декларация Всемирной медицинской ассоциации "Этические принципы, которые необходимо соблюдать при проведении медицинских исследований с участием человека" (1964) (на нее опирается нормативно-правовая база в области клинических испытаний лекарственных средств) находится по ссылке http://www.abcmedservice.ru/site.xp/049057051.html .
Перечисленные нормативно-правовые документы создают правовое поле для качественных и эффективных клинических испытаний лекарственных средств с прозрачной упрощенной процедурой экспертизы.
Министерство здравоохранения Украины своим Приказом № 186 от 17.05.2001 г. делегировало ГП "Государственный фармакологический центр" МЗ Украины (ГФЦ) функции управления и контроля в сфере регистрации лекарственных средств в пределах Закона Украины "О лекарственных средствах" без изменения подчинения на уровне заместителей министра. ГФЦ МЗ Украины имеет собственный WEB-сайт http://www.pharma-center.kiev.ua/diq_r.html , где можно найти всю касающуюся его деятельности информацию.
Клинические испытания лекарственных средств в Украине все больше интересуют зарубежных производителей в силу таких значимых факторов, как наличие в нашей стране крупных медицинских центров с квалифицированным медицинским персоналом и необходимым высококачественным оборудованием, а также достаточно большое население при относительно невысокой стоимости проведения клинических испытаний.
Именно этим, в частности, объясняется рост за десятилетний период количества многоцентровых клинических испытаний с участием украинских специалистов (более чем в 14 раз) при одновременном расширении числа утвержденных баз для проведения клинических испытаний (со 156 в 2001 г. до 362 в 2005 г.).
Организаторами международной конференции "Клинические исследования 2006" в Киеве вместе с ГФЦ МЗ Украины стали Институт клинических исследований (The Institute of Clinical Research) и компания National Bio
Science (http://www.zconferences.com/, http://www.nbscience.com/), оказывающие услуги в проведении клинических испытаний лекарственных препаратов. Одним из направлений работы этих компаний является организация международных медицинских конференций не только в нашей стране, но и за рубежом.
Участникам конференции были выданы сертификаты GCP международного образца, которые учитываются при проведении международных клинических исследований.
Редакция выражает благодарность Задорину Евгению Михайловичу за предоставленные материалы Конференции, что позволило дополнить статью таблицами из презентаций докладчиков.
Medicus Amicus #3, 2006
| 


















 Новости
Новости 