Вивчення профілю безпеки при фармакологічному нагляді - крок до цивілізованої регуляції обігу ліків в Україні
Вікторов О.П.
Державний фармакологічний Центр
МОЗ України
Відомо (WHO, 1999), що основними елементами регулювання ефективності і безпеки любого лікарського засобу (ЛЗ) є вичерпана та доведена характеристика його якості, ефективності, безпеки та об'єктивна інформація про препарат (від інструкції для медичного застосування до змісту реклами). Тому контроль за побічною дією (ПД) ЛЗ є одним з найважливіших напрямків діяльності національний служб охорони здоров'я (О.П.Вікторов та співавт., 2002).
В теперішній час встановлено, що крім давно відомих причин з боку медико-біологічних особливостей пацієнта та специфіки фармацевтичної і клініко-фармакологічної характеристик ЛЗ на розвиток ПД впливає ще цілий ряд чинників, які пов'язані із суспільними факторами (О.П.Вікторов та співавт., 2005):
- скорочення термінів експертної оцінки та прискорення процесу реєстрації нових та генеричних ЛЗ;
- постійне зростання кількості генеричних ЛЗ;
- зростаюча поширеність самолікування та проблеми некоректної реклами;
- фальсифікація ЛЗ;
- поширення БАДів;
- помилки лікарів та медичного персоналу;
- зростання витрат на лікувально-профілактичні заходи для "прикриття" ПД ЛЗ.
Невід'ємною частиною у здійсненні цих завдань як в межах міжнародної співпраці (WHO, EMEA, ISOP та ін.), так і в межах національної служби охорони здоров'я є ефективно діюча система фармакологічного нагляду. До основних методів впровадження фармакологічного нагляду відносяться (WHO, М.Н.Г. Дюкс, 1995):
- Спонтанні повідомлення - дозволяють здійснити контроль за ПД всіх ЛЗ, які дозволені до медичного застосування в країні; строки вивчення ПД не обмежені; існує можливість розподілу пацієнтів за відповідними групами; істотно не порушує перебіг подій; незначні витрати на дослідження.
- Активний моніторинг стаціонарів - базується на тому, що монітори збирають демографічні, соціальні та медичні дані на всіх пацієнтів, які поступають в стаціонар.
- Рецептурний моніторинг - базується на систематичному зборі та аналізі рецептів, які виписуються на новий ЛЗ; під час цього встановлюється контакт з лікарем, останній особисто повідомляє про дію препаратів.
- Вивчення в групах - принципово передбачає: визначення групи пацієнтів, які застосовують відповідний ЛЗ; визначення (виділення) контрольної групи пацієнтів (для порівняння); проведення порівняння між вказаними групами пацієнтів ефективності та безпеки фармакотерапії.
- Порівняльне вивчення - базується на відборі пацієнтів, для яких характерна визначена негативна реакція при призначенні відповідного ЛЗ, та пацієнтів, у яких відсутня визначена негативна реакція при застосуванні відповідного ЛЗ.
Створення в країні відповідно до Закону України "Про ліки" (1996) системи фармакологічного нагляду з однойменним координуючим відділом в структурі ДФЦ МОЗ України дозволило протягом останніх років впровадити в практику охорони здоров'я І рівень фармакологічного нагляду - постійне надходження спонтанних повідомлень про ПД ЛЗ від лікарів лікувально-профілактичних установ та органів охорони здоров'я. Останнє закріплено наказами МОЗ України 2001-2002 рр., а саме: №51 від 08.02.2001 р. "Про організацію подання інформації про побічну дію ЛЗ", №292 від 16.07.2001 р. "Про удосконалення організації подання інформації про побічну реакцію ЛЗ", №347 від 19.12.2000 р. "Про затвердження Інструкції про здійснення нагляду за побічними реакціями (побічними діями) лікарських засобів". Вперше в історії України вдалось створити національний банк повідомлень (статистична форма 137/о МОЗ України) про ПД дозволених в нашій державі для медичного застосування ліків. Банк даних ДФЦ МОЗ України містить за станом на 01.03.2005 р. понад 10 000 повідомлень про ПД ЛЗ, який постійно поповнюється (рис. 1).
Серед них, на жаль, частина випадків ПД містить інформацію про фатальне закінчення. В 1997-2004 рр. причинно-наслідковий зв'язок між клінічними проявами і наслідками ПД (смертю хворих) та клініко-фармакологічними особливостями підозрюваного ЛЗ був встановлений в 30 випадках.
Разом з тим, відповідно до наказів МОЗ України №51 від 08.02.2001 р. "Про організацію подання інформації про побічну дію ЛЗ", №292 від 16.07.2001 р. "Про удосконалення організації подання інформації про побічну реакцію ЛЗ", №347 від 19.12.2000 р. "Про затвердження Інструкції про здійснення нагляду за побічними реакціями (побічними діями) лікарських засобів", зареєстрованих Міністерством юстиції України, другим і не менш важливим джерелом інформації щодо випадків ПД ЛЗ головними мають бути (а в країнах ЄС є) виробники ЛЗ (мал. 2).
Як зазначено у наведених нижче документах ЄС, "...Власник торговельної ліцензії зобов'язаний гарантувати, що він володіє відповідною системою фармаконагляду, для того, щоб забезпечити виконання зобов'язань та нести відповідальність
за його продукцію, яка розміщена на ринку, та гарантувати, що при необхідності можуть бути застосовані відповідні заходи...". "...У розпорядженні власника торговельної ліцензії має знаходитись уповноважена особа, яка відповідає за фармакологічний нагляд...".
Уповноважена особа зобов'язана мати досвід в усіх областях фармаконагляду і, у випадку відсутності у неї медичної освіти, має бути підзвітною особі, яка має медичну освіту, або мати можливість звернутись до цієї особи.
Прізвище уповноваженої особи, яка відповідає за фармаконагляд, необхідно повідомити уповноваженим регуляторним органам держав ЄС, а також, якщо препарати зареєстровані за централізованою процедурою, Європейському Агентству.
В обов'язки уповноваженої особи входить :
- створення та функціювання системи, яка гарантує, що інформація про всі очікувані ПД, яка повідомляється персоналу компанії - власнику торгової ліцензії з агентами по продажу включно, буде збиратись та аналізуватись в одному місці в межах ЄС;
- підготовка для регуляторних уповноважених органів країн ЄС, в яких видана ліцензія на лікарський засіб, звітів, про які вказано в статті 29d Директиви Ради ЄС 75/319/ ЄС з внесеними змінами, а для ЛЗ, які ліцензувались за централізованою процедурою, - підготовка для Агентства та регуляторних уповноважених органів країн ЄС звітів, про які вказано в статті 22 Постанови Ради ЄС № 2309/93.
Досвід, накопичений в європейських країнах, дозволив на підставі розроблених в ЄС процедур здійснювати перехід до єдиних вимог реєстрації ЛЗ при входженні на загальноєвропейський ринок.
Європарламент також запропонував виробникам ЛЗ виділяти кошти на розвиток системи фармнагляду на підгрунті прибутку від впровадження нових ЛЗ, при цьому нормативна та юридична бази не повинні залежати від обсягу продажу ЛЗ.
Роль та обов'язки власників торговельних ліцензій визначена регулюючими документами (Постанова Ради ЄЕС №2309/93 (частина ІІ, розділ 3), Постанова Комісії ЄЕС №540/95, Директива Ради ЄЕС 75/319/ЄЕС із внесеними змінами (частина Vа):
- власник торговельної ліцензії несе відповідальність за продовження проведення оцінок з фармаконагляду в постліцензійний період та забезпечення гарантій того, що на всі запити регуляторних уповноважених органів щодо надання додаткової інформації, необхідної для оцінки користь/ризик при застосуванні ЛЗ, будуть надані вичерпні дані, в тому числі і про обсяги продажу або про кількість призначень відповідного ЛЗ;
- власник торговельної ліцензії надає компетентним органам будь-яку інформацію, яка необхідна для оцінки користь/ризик при застосуванні ЛЗ, включаючи відповідні дані про дослідження безпеки, які проводяться після надання торгової ліцензії;
- постліцензійні дослідження безпеки ЛЗ, які виробляються, фінансуються компанією-власником торговельної ліцензії.
В країнах ЄС після видачі ліцензії на лікарський засіб, навіть у випадках, коли препарат ще не вийшов на ринок, власник торгової ліцензії зобов'язаний надавати регулярно поновлювані звіти з безпеки лікарського препарату ( PSUR ). Регулярно поновлювані звіти щодо безпеки, як правило, необхідно надавати:
- негайно за запитом;
- кожні 6 місяців протягом перших двох років після отримання торговельної ліцензії в ЭС;
- 1раз на рік протягом наступних 2 років;
- разом з першою заявкою на перереєстрацію;
- 1раз на 5 років разом із заявкою на перереєстрацію;
Однак при вступі до ЄС на перехідний період регламентами співробітництва дозволяється тимчасове використання національного законодавства. Слід підкреслити, що, незважаючи на деяки відміни,
в світі склався узагальнений стандарт в цьому напрямку контролю.
В різних країнах порядок надходження інформації від виробника ЛЗ про ПД органам регуляторної системи має свою специфіку:
Регламенти ЄС вимагають від власників торговельних ліцензій надання
узагальнюючої інформації разом з критичною оцінкою співвідношення користь/ризик при застосуванні препарату у світлі нової інформації, яка отримана в постліцензійний період, або наявність змін в такій інформації. В процесі такої оцінки має бути встановлено, чи необхідно вносити зміни в торговельну ліцензію, коротку характеристику лікарського препарату, інструкцію-вкладиш та рекламу препарату.
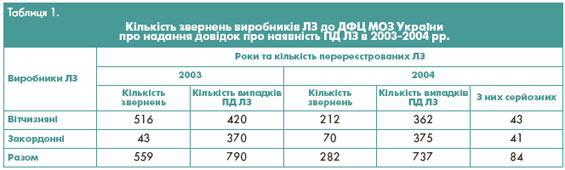
За другу половину 2004р. та початок 2005р. до ДФЦ МОЗ України вперше почали надходити узагальнені звіти (PSUR), переважно від іноземних виробників і декілька звітів від вітчизняних.
Але запитів щодо інформації про ПД ЛЗ власного виробництва отримуємо достатньо і поки що з наростаючою кількістю ( табл.1).
Недбале відношення до контролю за безпекою ЛЗ в Україні з боку виробників ліків або їх чинних представників яскраво ілюструється тим, що з майже 150 вітчизняних та більше 200 закордонних виробників ЛЗ власні структури або чинних представників для нагляду за ПД ЛЗ в Україні формально мають лише 22 (тобто менше 10%).
Відповідно до регламентів ЄС для оптимальної оцінки співвідношення користь/ризик при застосуванні лікарських препаратів уповноважений регуляторний орган зобов'язаний безперервно контролювати профіль безпеки препаратів, які застосовуються в державі, а у випадках необхідності приймати відповідні заходи та контролювати виконання власниками торговельних ліцензій (реєстраційних посвідчень) в Україні їх зобов'язань щодо відношення до фармакологічного нагляду.
Співвідношення користь/ризик при медичному застосуванні ЛЗ є головним критерієм при проведенні раціональної індивідуальної фармакотерапії за принципами доказової медицини. Користь від застосування ЛЗ може бути визначена за ступенем зниження важкості перебігу захворювання.
Зростання частоти надходжень інформації про відомі ПД на ЛЗ традиційно розглядається в країнах ЄС як важлива нова інформація. Хоча таке зростання кількості повідомлень слід обговорити в PSUR, неможливо надати спеціальні керівні вказівки відносно того, що означає таке зростання кількості повідомлень, та який метод
необхідно використати для визначення їх кількості. Власники торговельних ліцензій повинні надавати детальну інформацію щодо методів, які вони застосовують. Подібні ситуації слід ретельно обмірковувати, з тим щоб визначити, чи відбивають наявні дані значимі зміни частоти проявів ПД на ЛЗ або профілю безпеки та чи можливо запропонувати пояснення таких змін (наприклад, група населення, яка приймала
препарат, тривалість прийому). В зв'язку з зазначеним вище, вивчення профілю безпеки ЛЗ є одним з достовірних методів оцінки або обґрунтування співвідношення користь/ризик при медичному застосуванні конкретного ЛЗ.
Вивчення профілю безпеки є також одним з методів впровадження ІІ рівня фармакологічного нагляду моніторування ПД ЛЗ при його медичному застосуванні як різновид фармакоепідеміологічного дослідження за принципом "випадок-контроль ".
Відповідно до визначення, яке надають документи ЄС, постліцензійне (післяреєстраційне) дослідження безпеки - Post-authorisation Safety Study (PASS) є фармакоепідеміологічним дослідженням або клінічним дослідженням, яке виконується з метою ідентифікацій або визначення кількості ризиків по відношенню до безпечності зареєстрованого лікарського засобу.
Ці дослідження фінансуються виробником і мають за мету дати клінічну оцінку безпеки ліків, які знаходяться в обігу в повсякденній клінічній практиці (вони мають забезпечити можливість запропонувати гіпотезу або перевірити її).
Власникам торгових ліцензій (в Україні реєстраційних свідоцтв), які збираються провести такі дослідження, рекомендується обговорити проект протоколу дослідження з відповідними регуляторними органами.
Центр з фармаконагляду може здійснювати перевірку досліджень, які проводяться в межах його юрисдикції. Повідомлення про всі серйозні побічні реакції, які були виявлені на підставі цих досліджень, мають
бути надані до Центру власником торгової ліцензії або дослідником звичайним чином та розглядатись за наступною процедурою. Тобто, таким чином
звіт щодо профілю безпеки препарату розглядається регуляторним органом, зпівставляється з аналітичними даними фармаконагляду, який лише тільки після цього пропонує проект відповідного рішення, якщо є необхідність прийняття термінових (екстрених) заходів.
Підстави для заборони (зупинки) і вилучення ЛЗ із обігу на території України (наказ МОЗ України від 12.12.01 №497)
В 2004-2005 рр. вперше в Україні вже проведене вивчення профілю безпеки наступних препаратів:
- Фуразолідон (таблетки по 0,05г №10, №20) виробництва ВАТ "Луганський ХФЗ"
- Ніфуроксазид (таблетки, вкриті оболонкою, по 0,01 г та суспензія 220 мг/5 мл по 90 мл у флаконах) виробництва Гродзинського ФЗ "Польфа"
- Фуразолідон (таблетки по 0,05 г ) виробництва ВАТ "Монфарм"
- Фуразолідон (таблетки по 0,05 г) виробництва АТ "Галичфарм".
Звіти перших двох вже пройшли експертну оцінку в ДФЦ МОЗ України, були обговорені та затверджені на засіданні науково-експертної Ради Центру і зазначені препарати були рекомендовані до перереєстрації в Україні.
Medicus Amicus #4, 2005
Medicus Amicus #5, 2005
|


















 Новости
Новости 