
|
|
|
ПСИХУШКА ЗА ПОБЕГ ИЗ ДЕТДОМА
Две недели назад в Гражданскую комиссию по правам человека поступило очередное сообщение по поводу того, что 15-летнего подростка поместили из обычного детского дома в психиатриче..
| Мой путь в немецкую клинику
Немецкая медицина является для многих врачей одним из эталонов качества, надежности и мастерства. Это и неудивительно - мне, как хирургу, в своей повседневной клинической деятельно..
| Как сдавать PLAB экзамены
лицензии на работу врачом в Великобритании. Однако ему должна предшествовать успешная (с проходным баллом 7) сдача теста по английскому языку (IELTs)...
| Каким быть ногтям медицинского работника
Всемирная организация здравоохранения (ВОЗ) обращает внимание на то, что искусственные акриловые ногти способствуют сохранению контаминации рук после использования мыла или содержа..
| Охота на фармацевтов и врачей
Две трети судебных юристов США, зарабатывающих на процентах от отсуженных компенсаций пострадавшим, специализируются на "медицинских" процессах - исках к производителям лекарств и..
| Клонирован мочевой пузырь
Клонирование человека - дилемма. Клонирование отдельных органов - мечта. Возможность менять старые, отработавшие, больные органы на новые будоражит умы и врачей, и пациентов. Актуа..
| Наш мир в возрасте 84 лет 14 апреля 2003 года покинула Любовь Трофимовна Малая, Герой Украины, Герой Социалистического Труда, кавалер ордена Трудового Красного Знамени; орденоносец..
| Нобелевская премия за поцелуй смерти
Нобелевская премия поцелуй обмен белками при поцелуе
Нобелевская премия за "поцелуй смерти"
Человеческая клетка содержит несколько сотен тысяч различных белков, которые принимают участие в ферментативных реакциях, гормональной регуляции, иммунной защите, а также
в формировании клеточной формы и структуры.
Лауреаты Нобелевской премии 2004 года в области химии Аарон Цехановер (Aaron Ciechanover), Авраам Гершко (Avram Hershko) и Ирвин Роуз (Irwin Rose) открыли и тщательно изучили один из
наиболее важных биохимических процессов, происходящих в клетке, - убиквитинопосредованное расщепление белков. В ходе этой реакции дефектный белок, подлежащий уничтожению, метится биохимическим маркером - полипептидной молекулой, получившей
название убиквитин. Такая маркировка получила эффектное название "поцелуя смерти". Меченые белки далее поступают в своеобразный "центр утилизации" клетки - протеасому, где и расщепляются на составляющие их аминокислоты, из которых
потом синтезируются новые белки.
Открытие протеин-регуляторной системы позволило объяснить на молекулярном уровне, каким образом клетка контролирует огромное количество важнейших биохимических процессов, таких как клеточный
цикл, восстановление ДНК, транскрипция генов, контроль качества вновь синтезированных белков. Полученные знания также легли в основу понимания механизмов иммунного ответа клеток.
На протяжении прошлого века достаточно большое количество научных исследований было посвящено изучению процессов синтеза клеточных белков. По меньшей мере пять Нобелевских премий
были присуждены за открытия в этой научной области. Проблема разрушения белков казалась гораздо менее значимой. В то время были уже хорошо известны энзимы, способные разрушать простые протеины (например, трипсин, расщепляющий белки
пищи до аминокислот). Достаточно хорошо была изучена функция клеточной органеллы - лизосомы, в которую белки адсорбировались извне и претерпевали дальнейшие преобразования. Важно, что все эти процессы разрушения белков не требовали дополнительной энергии.
В 1950-х годах в ходе экспериментальных исследований возникло предположение, что для разрушения некоторых клеточных протеинов необходима дополнительная энергия. Примерно с этого
времени началась кропотливая работа специалистов в области биологической химии, позволившая в конечном итоге досконально объяснить сложные процессы распада клеточных белков и заслуженно отмеченная Нобелевской премией 2004 года.
Первым шагом на пути понимания энергозависимых процессов разрушения
белков явились результаты работы Голдберга(Goldberg) и его коллег, которым в 1977 году удалось получить cell-free экстракт из незрелых клеток крови, ретикулоцитов, который катализировал распад протеинов по так называемому АТФ-зависимому типу, то есть с использованием дополнительной клеточной энергии.
Используя такой экстракт, Аарон Цехано вер, Авраам Гершко и Ирвин Роуз в результате серии биохимических исследований в конце 70-х - начале 80-х годов наглядно продемонстрировали, что процесс разрушения белка в клетках является результатом серии химических реакций, которые нуждаются в дополнительной энергии и проходят при обязательном участии полипептидного маркера - убиквитина.
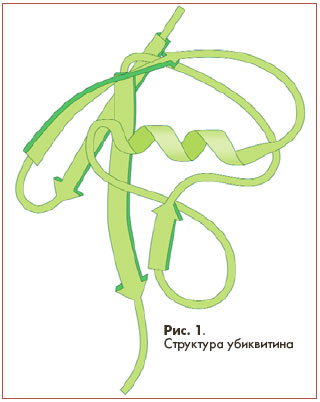
Убиквитин (от латинского слова ubique - везде, повсюду) является полипептидом и состоит из 76 аминокислот (рис.1). Впервые был выделен из железистой ткани теленка, а впоследствии обнаружен учеными в большом количестве тканей различных живых организмов (кроме бактерий).
Начиная с 1977 года ученые шаг за шагом продвигались к окончательной разгадке механизма разрушения клеточных белков, и в период с 1981 по 1983 годы Цехановер, Гершко и Роуз
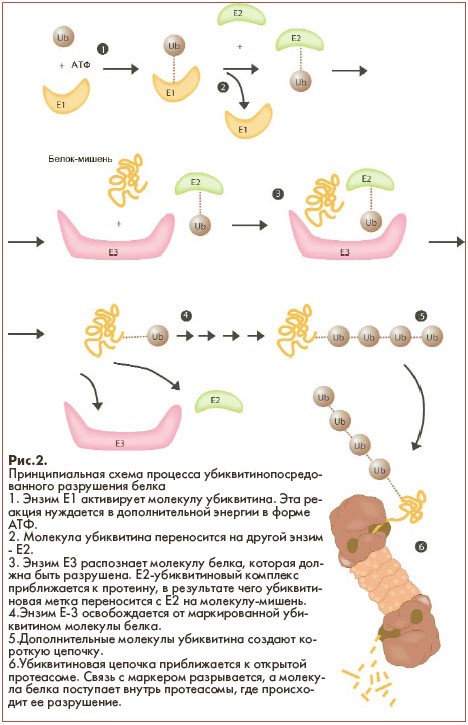
сформулировали многостадийную убиквитин-опосредованную гипотезу (the multistep ubiquitin-tagging hypothesis), основанную на взаимодействии убиквитина, трех энзимов (Е1, Е2, Е3) и молекулы АТФ (рис.2).
На сегодняшний день известно, что типичная клетка
млекопитающих содержит один или несколько различных Е1-энзимов, несколько десятков Е2- и несколько сотен Е3-энзимов. Именно энзимам Е3 принадлежит ключевая роль в цепочке реакций, потому что эти молекулы определяют, какой белок должен быть помечен для деструкции в протеасомах.
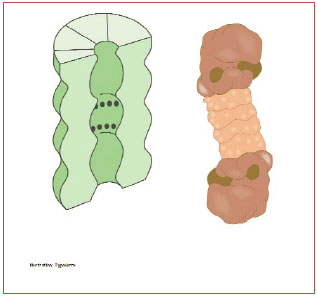
Человеческая клетка содержит около 30000 протеасом (рис.3).
Это бочкообразные
внутриклеточные структуры, разрушающие практически все белки до 7-9 аминокислотных пептидов. Активная поверхность протеасомы находится внутри "бочки", куда и попадают меченные убиквитином белки. Пептиды высвобождаются с другого
конца протеасомы. Сама протеасома не способна отбирать белки для разрушения. Как уже отмечалось выше, это происходит с помощью сложной системы взаимодействия энзимов и убиквитина.
Для более глубокого изучения физиологической функции убиквитинопосредованной системы разрушения белков Авраам Гершко и его сотрудники использовали иммунохимический метод. Используя меченые антитела к убиквитину,
ученые установили, что в клетках примерно 30% вновь синтезированных белков не проходят "контроль качества", получают убиквитиновую метку и разрушаются в протеасомах.
На основании выдающихся открытий, сделанных лауреатами Нобелевской премии 2004 года, удалось объяснить ряд физиологических и патологических процессов, важную роль в которых играет убиквитинопосредованное разрушение белков. Рассмотрим некоторые из них.
Регуляция клеточного цикла
Когда клетка создает свою копию, в процессе принимает участие множество химических реакций. Деление обычной клетки (митоз) и образование половых клеток (мейоз) имеют много точек
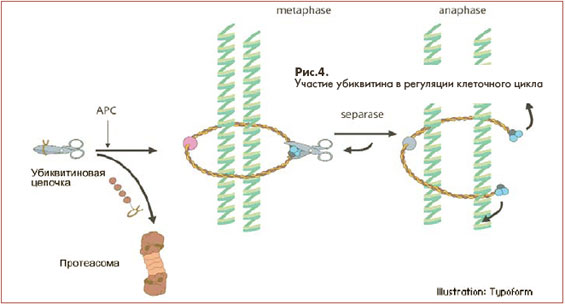
соприкосновения с объектами, которые изучали нобелевские лауреаты. Например, E3 участвует в активизации анафаза-стимулирующего комплекса энзимов (anaphase-promoting complex - АРС) который запускает процесс деления клетки. На схеме (рис. 4) он условно изображен в виде ножниц. АРС играет важную роль в разделении хромосом в процессе митоза и мейоза, разрушая
протеиновый комплекс, который подобно канату удерживает хромосомную пару.
Для высвобождения АРС его специфический белковый ингибитор, удерживающий комплекс в неактивном состоянии, получает "поцелуй смерти" и вовлекается в процесс, который заканчивается разрушением его в протеасоме. Освобожденный энзим разрушает "канат", удерживающий хромосомную пару.
Сбой в вышеописанном механизме в процессе мейоза приводит к врожденным хромосомным аномалиям. Большинство злокачественных опухолей имеют клетки с измененным числом хромосом вследствие подобных нарушений в процессе митоза.
Восстановление ДНК, рак и запрограммированная гибель клетки
Протеин p53 имеет титул "защитника генома" и играет исключительно важную роль в предотвращении развития опухолевого процесса. Дело в том, что p53 вызывает экспрессию генов, которые управляют процессами восстановления ДНК, а также запрограммированной гибели клетки. В норме относительно
невысокий оптимальный уровень р53 в клетке регулируется постоянными процессами адекватного синтеза и убиквитинопосредованного разрушения. В случае повреждения ДНК протеин p53 фосфорилируется и более долгое время находится в связанном с энзимом Е3 состоянии, что приводит к замедлению процессов его разрушения и увеличению количества белка в клетке.
Увеличение уровня p53 приводит к прерыванию клеточного цикла с целью предоставления дополнительного времени для восстановления поврежденной ДНК и экспрессии соответствующих генов. Если же повреждение слишком большое и не может быть восстановлено, запускается программа клеточной смерти или, другими словами, клетка совершает "самоубийство".
Вирус человеческой папилломы, являющийся этиологическим
фактором развития рака шейки матки, аннулирует функцию контроля протеина p53. Происходит это с помощью одного из белков вируса, который, выполняя извращенную функцию энзима Е3, приводит к присвоению убиквитиновой метки протеину р53 и, как следствие, к его массовому разрушению. В результате в инфицированной клетке нарушаются процессы восстановления
ДНК, а также не запускается процесс запрограммированной гибели клетки. Как следствие, возрастает количество мутаций, что может приводить к развитию рака.
Иммунные и воспалительные реакции
Определенный транскрипционный фактор регулирует активность ряда генов в клетке, которые являются важными для запуска реакций иммунной защиты и воспаления. Этот транскрипционный фактор находится в неактивном состоянии, сдерживаемый белком-ингибитором в цитоплазме клетки.
Когда клетка обнаруживает бактерию или другие сигнальные субстанции, белок-ингибитор фосфорилируется, помечается убиквитином и затем разрушается в протеасоме. Освобожденный транскрипционный фактор транспортируется к клеточному ядру, где связывается и активирует экспрессию специфических генов.
Также убиквитин-протеасомная система,
разрушая протеины вируса, продуцирует пептиды, которые на поверхности инфицированной вирусом клетки распознают Т-лимфоциты. Последние атакуют клетку, что является важной частью защиты против вирусной инфекции.
В последние годы убиквитиновая система попала в сферу интересов исследователей, разрабатывающих новые медикаменты, предназначенные для лечения различных
заболеваний. Препараты, воздействующие на отдельные компоненты убиквитинопосредованного расщепления, могут предотвратить разрушение специфических протеинов. С другой стороны, можно, наоборот, активизировать систему разрушения нежелательных белков. В настоящее время проходит клиническое тестирование протеасомный ингибитор Velcade (PS341),
который применяется против множественной миеломы. Изучение различных процессов в клетке, контролируемых убиквитинопосредованной системой разрушения белков, продолжается в настоящее время во многих лабораториях мира.
Illustrations: Typoform
http://nobelprize.org
Medicus Amicus #2, 2005
|
|
|
|
|
|

|  Новости Новости
| « Январь ´26 » |
| П | В | С | Ч | П | С | В | | | | | 1 | 2 | 3 | 4 | | 5 | 6 | 7 | 8 | 9 | 10 | 11 | | 12 | 13 | 14 | 15 | 16 | 17 | 18 | | 19 | 20 | 21 | 22 | 23 | 24 | 25 | | 26 | 27 | 28 | 29 | 30 | 31 | |
01/01/15 - Уважаемые коллеги! От всей души поздравляем с Новым 2015 годом! Крепкого здоровья, успехов в профессиональной деятельности и простого Вам человеческого счастья! 02/01/15 - Разделы сайта пополнены новыми статьями 10/01/15 - Разделы сайта пополнены новыми статьями 20/01/15 - Разделы сайта пополнены новыми статьями 26/01/15 - Разделы сайта пополнены новыми статьями |
|

















 Новости
Новости 