ПСИХУШКА ЗА ПОБЕГ ИЗ ДЕТДОМА
Две недели назад в Гражданскую комиссию по правам человека поступило очередное сообщение по поводу того, что 15-летнего подростка поместили из обычного детского дома в психиатриче..
| Мой путь в немецкую клинику
Немецкая медицина является для многих врачей одним из эталонов качества, надежности и мастерства. Это и неудивительно - мне, как хирургу, в своей повседневной клинической деятельно..
| Как сдавать PLAB экзамены
лицензии на работу врачом в Великобритании. Однако ему должна предшествовать успешная (с проходным баллом 7) сдача теста по английскому языку (IELTs)...
| Каким быть ногтям медицинского работника
Всемирная организация здравоохранения (ВОЗ) обращает внимание на то, что искусственные акриловые ногти способствуют сохранению контаминации рук после использования мыла или содержа..
| Охота на фармацевтов и врачей
Две трети судебных юристов США, зарабатывающих на процентах от отсуженных компенсаций пострадавшим, специализируются на "медицинских" процессах - исках к производителям лекарств и..
| Клонирован мочевой пузырь
Клонирование человека - дилемма. Клонирование отдельных органов - мечта. Возможность менять старые, отработавшие, больные органы на новые будоражит умы и врачей, и пациентов. Актуа..
| Наш мир в возрасте 84 лет 14 апреля 2003 года покинула Любовь Трофимовна Малая, Герой Украины, Герой Социалистического Труда, кавалер ордена Трудового Красного Знамени; орденоносец..
| Подходы ВОЗ к лекарственному обеспечению. Примерный перечень основных лекарств
лекарственное обеспечение Перечень лекарственных средств использование лекарств Оценка фармацевтических продуктов Закупка лекарств
Подходы ВОЗ к лекарственному обеспечению. Примерный перечень основных лекарств
Сур С.В.
заместитель главного государственного инспектора Украины
по контролю качества лекарственных средств, эксперт ВОЗ
В подавляющем большинстве стран мира существуют проблемы, связанные с обеспечением
лекарствами. В промышленно развитых, т.н. "богатых" странах основными проблемами являются избыток лекарств на рынке, их излишнее потребление, повышенные расходы общества на оплату потребляемых медикаментов, конфликт интересов у тех,
кто осуществляет оценку новых препаратов и регулирует их цены, фальсификация лекарств, нетарифные барьеры на пути экспорта и импорта и т.п.
У "бедных", развивающихся государств другие проблемы - нехватка медикаментов,
их нерациональное использование, очень часто неудовлетворительное качество лекарств, малодоступные для многих потребителей цены, трудности с распределением. Причины этих трудностей носят комплексный характер и связаны они не только с
недостатком финансовых ресурсов, но и с организационными, политическими и кадровыми проблемами. Очевидно, что эти проблемы также характерны сегодня для Украины и других стран СНГ.
Опыт многих стран показал, что, несмотря на всю серьезность проблем, стоящих перед развитыми странами, трудности "бедных" стран преодолевать значительно сложнее. Для облегчения этой задачи
ВОЗ рекомендует странам разработать и принять на государственном уровне документ, определяющий приоритетные задачи в сфере лекарственного обеспечения и основные пути их решения - т.н. "Национальную лекарственную политику"
(НЛП) [1]. Такой документ может также называться программой или стратегией развития фармацевтического сектора. В соответствии с рекомендациями ВОЗ основу такого документа должны составлять положения принципиального характера
и длительного действия, например намерения правительства обеспечить население лекарственными средствами по доступным ценам, приверженность концепции основных лекарств, курс на преимущественное использование воспроизведенных
препаратов (генериков) и т.п. В документе сопоставляются потребности в лекарствах с имеющимися ресурсами (финансовые средства для импорта, собственное производство и т.п.). Следует отметить, что в Украине в 2003 г.
Постановлением Кабинета Министров была принята Государственная программа обеспечения населения лекарственными средствами [2], которая в целом отвечает указанным рекомендациям ВОЗ [1].
Основными элементами НЛП, которые связаны между собой и должны использоваться в комплексе, являются:
Выбор жизненно необходимыхи важнейших лекарственных препаратов
Перечень "основных" лекарственных средств согласно рекомендациям ВОЗ является центральным звеном национальной лекарственной политики. Поскольку ни одна государственная система
или система медицинского страхования не в состоянии поставлять или возмещать стоимость всех лекарств, находящихся на рынке, то выбор ограниченного числа таких лекарств, желательно включенных в национальные рекомендации по лечению,
позволяет обеспечить их доступность и содействует рациональному использованию. С середины 70-х годов ВОЗ издает и регулярно пересматривает т.н. "типовой перечень основных лекарств", рекомендуемых в качестве основы для составления
национальных перечней. Последний перечень основных лекарств ВОЗ, включающий в основной и дополнительный список препараты с около 400 активными веществами, был утвержден в апреле 2002 г. [3] и будет пересматриваться в 2004 г.
Рациональное использование лекарств
Удовлетворение потребности в лекарствах в условиях ограниченных ресурсов не может быть достигнуто без активной пропаганды их рационального использования, проводимой национальными
органами здравоохранения. Основными элементами при этом являются наличие перечня важнейших лекарств, официальные (т.е. утвержденные органами здравоохранения) инструкции по их применению, национальный формуляр, издаваемый государственными
органами или компетентными общественными организациями, проводимые государственными органами (а не фиpмами-пpоизводителями) симпозиумы и конференции, посвященные применению отдельных препаратов и рациональной
лекарственной терапии в целом. Сюда же можно отнести своевременное информирование медицинских работников о зарегистрированных побочных действиях лекарств, в особенности новых.
Определение потребности
Опыт не только социалистических стран, но и государств с рыночной экономикой показал, что потребность на среднесрочный период (свыше одного года-двух лет) по отдельным препаратам и группам
можно только прогнозировать, но не планировать. В этих целях используются: методика "определенных дневных доз" (DDD), разработанная одним из сотрудничающих центров ВОЗ, подходы, основанные на учете пропускной способности лечебных учреждений,
а также закрытая статистика потребления, получаемая от коммерческих баз данных. Для подготовки крупных тендеров потребность чаще всего рассчитывается на 2 года.
Оценка фармацевтических продуктов и их регистрация
Согласно общепринятой в развитых странах практике и рекомендаций ВОЗ, регистрация означает процесс и результат оценки документов, характеризующих эффективность, безопасность (безвредность)
и качество нового фармацевтического продукта (готовой лекарственной формы) начиная с первичного рассмотрения представленных документов на предмет их комплектности и соответствия установленным требованиям. При этом в понятие "качество"
входят данные о химических и фармацевтических свойствах продукта, а также об условиях его производства на конкретном предприятии. Следует также отметить, что в мировой практике не принято разрешать лекарства к "медицинскому применению",
поскольку это считается компетенцией врача. При положительной оценке фармацевтический продукт разрешается к продаже или к сбыту в данной стране (Marketing Authorization).
Понятие "регистрация лекарств" включает не только систему регистрации, т.е. сумму технических требований к представляемым документам и порядок их рассмотрения, но и регистрационную
политику. Сколько продуктов целесообразно зарегистрировать всего, сколько - по отдельным терапевтическим группам, сколько должно быть аналогов одного препарата и т.п.
Закупка лекарств для общественного сектора
С упомянутой выше регистрационной политикой тесно связана практика закупок для общественного (т.е. государственного) сектора здравоохранения, в первую очередь для лечения приоритетных
заболеваний. Наиболее рациональным методом таких закупок, особенно в сфере импорта, признано использование
тендеров, в первую очередь открытых международных. Наряду с этим широко распространена практика закрытых тендеров на базе перечня потенциальных поставщиков, прошедших т.н. "предварительную квалификацию". Для включения в такой перечень
разрабатываются и утверждаются критерии: достаточная надежность в части качества и сроков поставки, конкурентные цены, широкий ассортимент, позволяющий свести к минимуму число исполнителей одного государственного заказа, и т.п.
Поставка и распределение
Для улучшения доступа к основным лекарствам должна функционировать надежная система поставок. При оптимальном сочетании государственных и частных структур такая система должна
обеспечивать надлежащую практику закупок для государственного сектора, применять систему публикации информации о ценах на исходное сырье и готовую продукцию, быть способной работать в чрезвычайных ситуациях, обеспечивать входной
контроль, предотвращать порчу лекарств, удалять из обращения некачественные, фальсифицированные препараты и лекарства с истекшим сроком годности.
Цены, возмещение расходов
Ценообразование в отрасли, доля расходов на лекарственное обеспечение, которую оплачивает сам потребитель, и смежные вопросы горячо обсуждаются во многих странах, и полностью удовлетворительных ответов пока не найдено. Практика отдельных стран варьирует от свободных цен (США, Швейцария) до жесткого
регулирования (Италия, частично Франция, некоторые Скандинавские страны). Также по-pазному решается вопрос о том, кто, в какой форме и степени берет на себя основную часть расходов по оплате потребляемых медикаментов.
Консенсус достигнут в отношении того, что здоровые оплачивают основную часть расходов на лекарства для больных. При этом в большинстве стран больные вначале покупают нужные им лекарства
за наличные и лишь потом их расходы возмещаются. Механизм компенсации затрат на покупку лекарств различен: в Великобритании эти расходы берет на себя государственный бюджет (через Минздрав), в большинстве других стран перераспределение
осуществляется через страховые компании.
Наиболее острые споры ведутся не столько в отношении конкретных цен, сколько вокруг того, какую часть затрат на лекарства должен нести сам пациент и о связанных с этим деталях (например, должен ли пациент сам оплачивать покупку препаратов ручной продажи, не относящихся к перечню наиболее важных, и т.п.).
В связи с неоднократными заявлениями правительства о намерении регулировать цены необходимо учитывать, что прямое регулирование цен при кажущейся легкости на практике оказывается крайне сложным.
Достаточно вспомнить грандиозный скандал, разразившийся недавно в Италии вокруг председателя комитета по ценам на лекарства проф. Поджолини. Еще ранее некоторые страны, пошедшие этим путем, вынуждены были от него отказаться (Испания).
Более перспективной представляется практика (Великобритания) переговоров с промышленностью, с постепенным подталкиванием ее в сторону "добровольного" снижения цен.
Лицензирование предприятий
Лицензирование предприятий отрасли является неотъемлемым элементом государственного регулирования лекарственного рынка. В мире уже достаточно давно действует принцип: "От зарегистрированных препаратов
- к лицензированным производителям". В последние 10-15 лет особое внимание уделяется лицензированию оптовых компаний, в первую очередь - импортеров. При этом в центр лицензионной практики ставится соблюдение официальных нормативов и
методических указаний (GMP, аналогичных требований к импортерам и оптовикам). В странах Европейского Союза одним из главных требований является необходимость наличия в штате компании т.н. "квалифицированного лица".
Контроль качества
При выборе поставщиков для государственного сектора нередко возникает ситуация,
при которой в качестве потенциального рассматривается (как правило, по ценовым соображениям) поставщик, продукты которого еще не зарегистрированы. В этих случаях не рекомендуется выбирать поставщика исходя из наиболее низкой цены,
а затем решать вопрос - отвечает ли его продукция нормам качества. Практика показывает, что в такой ситуации закупочная
организация легко склоняется к компромиссу в части качества. Более правильным было бы вначале установить четкие критерии в отношении качества (включая соблюдение правил GMP), очертить круг потенциальных поставщиков, отвечающих этим
требованиям на основании объективных оценок, после чего из данного перечня выбрать поставщика, предлагающего наиболее выгодные условия поставки (включая цены).
В отношении продуктов, уже поступивших в сеть распределения, контроль качества
сводится к проверке (инспекционным и аналитическим методом) соблюдения условий, на которых продукт был зарегистрирован, а предприятие по производству или оптовой торговле получило лицензию на право заниматься данным видом
деятельности. При этом общемировой тенденцией является сокращение доли аналитического контроля за счет усиления инспектирования и/или использования сертификации (хотя в последнее время в связи с опасностью фальсификации лекарств в
рекомендациях ВОЗ говорится о необходимости возврата к увеличению лабораторных проверок образцов лекарств, отобранных у оптовиков и аптек).
Реклама, информация
Рекламно-инфоpмационная деятельность производителей должна осуществляться в соответствии с этическими критериями ВОЗ для продвижения лекарств на рынок. Самый надежный способ добиться этого - включить критерии ВОЗ в национальное законодательство.
Исследования
Исследования являются важным инструментом для оценки влияния лекарственной политики на систему национального здравоохранения, для изучения экономических аспектов поставки лекарств,
изучения проблем назначения лекарств и понимания социокультурных аспектов их использования. Проведение исследований дает возможность для успешного внедрения, мониторинга и оценки различных аспектов лекарственной политики.
Подготовка и повышение квалификации кадров
Основные компоненты национальной лекарственной политики: использование международных непатентованных наименований лекарств, рациональная фаpмакотеpапия, концепция основных лекарств, современные принципы доклинического изучения и клинических испытаний фармацевтических продуктов обеспечения и контроля
их качества и т.д. должны включаться в программы медицинских и фармацевтических вузов, курсов переподготовки и повышения квалификации специалистов общественного сектора здpавоохpанения.
Мониторинг и оценка
Регулярный мониторинг и оценка изменений в фармацевтическом секторе с помощью разработанных критериев и индикаторов позволяет оценить эффективность внедрения национальной лекарственной политики,
а также ее влияния на все отрасли экономики и общество в целом. В связи с этим рекомендуется предусмотреть необходимые ресурсы для проведения мониторинга и оценки, желательно группой независимых внешних экспертов.
Для иллюстрации комплексного подхода к вопросам лекарственной политики можно привести алгоритм создания примерного перечня основных лекарственных средств ВОЗ и связанных с ним документов.
Согласно определению ВОЗ [4] основные лекарственные средства должны удовлетворять потребности первичного звена здравоохранения. Основная идея концепции основных лекарственных средств
ВОЗ состоит в том, что "ограниченный перечень тщательно отобранных основных лекарств способствует лучшему лечению, управлению обеспечением лекарствами и снижает их стоимость".
Критериями выбора лекарств для включения в такой перечень являются их применение для профилактики и лечения приоритетных заболеваний, доказанная эффективность и безопасность,
учет соотношения стоимости и эффективности этих препаратов. Лекарства из основного списка должны быть доступными в условиях действующей системы здравоохранения в любое время, в необходимых количествах, в подходящих лекарственных формах, гарантированного качества и стоимости, которая доступна для отдельных граждан и общества.
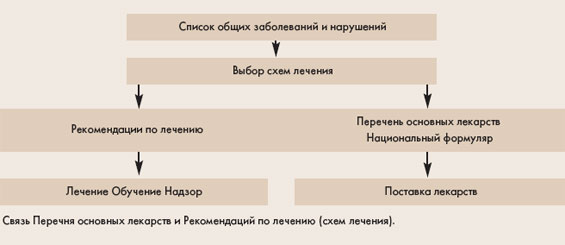
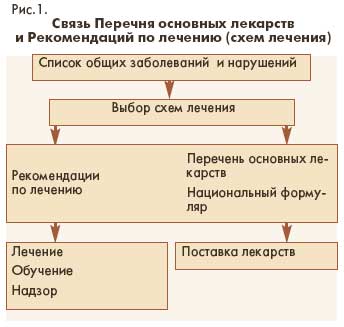
Процедура выбора препарата в перечень основных лекарств в первую очередь зависит от его использования в рекомендованных ВОЗ схемах лечения (см. рис.1). После включения в схемы лечения
приоритетных заболеваний препарат вносится в Перечень основных лекарств с указанием международного непатентованного названия, лекарственной формы и дозировки. Эти сведения для всех препаратов перечня, а также информация по показаниям, противопоказаниям, возможным побочным действиям включается в Формуляр.
Перечень основных лекарств является основанием и исходным пунктом для определения стоимости схем лечения, потребности в лекарствах, а также подготовки документов и материалов для контроля
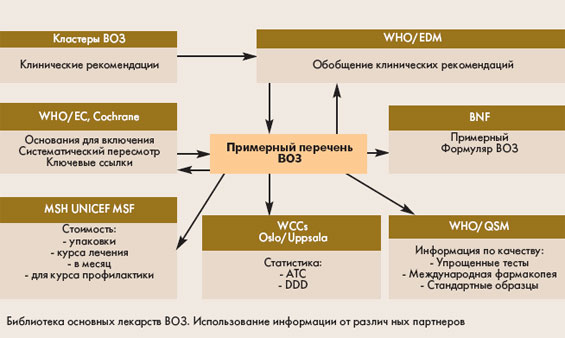
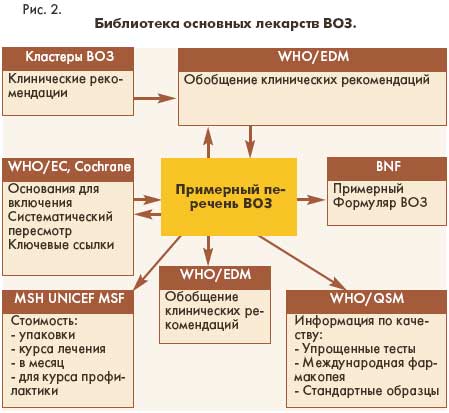
качества включенных в него препаратов. К последним относятся рекомендации по проведению упрощенных тестов с помощью цветных реакций и тонкослойной хроматографии для идентификации и выявления подделок лекарств, монографии Международной
фармакопеи ВОЗ для активных субстанций и готовых лекарственных форм, стандартные образцы ВОЗ и т.д. На рис.2 показано, какие организации и подразделения ВОЗ принимают участие в подготовке этой информации.
Использование информации от различных партнеров
Такая система имеет ряд недостатков: нечетко определен перечень заболеваний, для лечения которых используются лекарства из Перечня; временной разрыв между утверждением схем лечения и Перечня приводит к их неполному соответствию; выбор лекарств для Перечня основывается, скорее, на консенсусе экспертов,
чем на экспериментальных доказательствах; бывает сложно оценить соотношение стоимость/эффективность и т.д. Тем не менее использование Перечня основных лекарств, связанного с другими документами ВОЗ, для подготовки соответствующих
национальных документов позволяет, в целом, решать задачи эффективности, доступности и рационального использования лекарственных средств в странах с ограниченными ресурсами.
Следует отметить, что в Украине на сегодня имеются не все вышеперечисленные элементы НЛП, а имеющиеся не всегда эффективны и оптимальны и не связаны друг с другом.
Так, сегодня в Украине утвержденные схемы лечения ряда заболеваний отсутствуют или носят рекомендательный (т.е. не обязательный для использования) характер. Одним из исключений являются схемы лечения больных ВИЧ/СПИД, утвержденные приказом МЗ Украины.
В стране существует не менее 4 перечней лекарственных средств ("жизненно важных лекарств", "лекарств, которые могут закупаться организациями и учреждениями здравоохранения, полностью
или частично финансируются из государственного или местного бюджетов", "лекарственных средств… цены на которые подлежат государственному регулированию" и др.). В эти перечни входит от нескольких сотен до нескольких тысяч лекарств,
причем часто с указанием не международных непатентованных, а фирменных названий (что делает такие перечни неэффективными с точки зрения ВОЗ и устаревшими сразу после утверждения, т.к. в стране постоянно регистрируются новые
генерики, а часть препаратов не перерегистрируется).
Существующая система централизованных закупок и поставок лекарств для лечения приоритетных заболеваний в рамках национальных программ по лечению сахарного диабета, туберкулеза,
онкологических заболеваний, ВИЧ/СПИД имеет ряд недостатков (отсутствие процедуры предварительной квалификации поставщиков; закупка и поставка сразу годового заказа в региональные лечебные учреждения, которые не имеют специалистов и
помещений для хранения больших запасов лекарств). Это часто приводит к потерям лекарств из-за окончания срока годности препаратов и их порчи при хранении в ненадлежащих условиях.
Постановлением Кабинета Мини-стров Украины от 25.07.03 №1162 принята Государственная программа обеспечения населения лекарствен-ными средствами на 2004 - 2010 годы, предусматривающая
объедине-ние разрозненных сегодня элементов лекарственного обеспечения и создание целостной системы.
Выводы:
- Для решения проблем лекарственного обеспечения ВОЗ рекомендует странам с ограниченными ресурсами разработать и внедрить программу развития фармацевтического сектора (так называемую "Национальную Лекарственную Политику").
- Важнейшим элементом Национальной Лекарственной Политики является Перечень основных лекарственных средств.
Литература:
1. How to develop and implement a national drug policy. 2nd ed. - World Health Organization, Geneva. - 2001.- 83 p.
2. Постанова Кабінету Міністрів України від 25.07.03 № 1162 "Про затвердження Державної програми забезпечення населення лікарськими засобами на 2004 - 2010 роки".
3. WHO Model List of Essential Medicines //WHO Drug Information. - 2002. - Vol. 16. - No 2. - P.139-154.
4. Report to WHO Executive Board, January 2002.
Medicus Amicus 2004, #5
|
|














 Новости
Новости 