ПСИХУШКА ЗА ПОБЕГ ИЗ ДЕТДОМА
Две недели назад в Гражданскую комиссию по правам человека поступило очередное сообщение по поводу того, что 15-летнего подростка поместили из обычного детского дома в психиатриче..
| Мой путь в немецкую клинику
Немецкая медицина является для многих врачей одним из эталонов качества, надежности и мастерства. Это и неудивительно - мне, как хирургу, в своей повседневной клинической деятельно..
| Как сдавать PLAB экзамены
лицензии на работу врачом в Великобритании. Однако ему должна предшествовать успешная (с проходным баллом 7) сдача теста по английскому языку (IELTs)...
| Каким быть ногтям медицинского работника
Всемирная организация здравоохранения (ВОЗ) обращает внимание на то, что искусственные акриловые ногти способствуют сохранению контаминации рук после использования мыла или содержа..
| Охота на фармацевтов и врачей
Две трети судебных юристов США, зарабатывающих на процентах от отсуженных компенсаций пострадавшим, специализируются на "медицинских" процессах - исках к производителям лекарств и..
| Клонирован мочевой пузырь
Клонирование человека - дилемма. Клонирование отдельных органов - мечта. Возможность менять старые, отработавшие, больные органы на новые будоражит умы и врачей, и пациентов. Актуа..
| Наш мир в возрасте 84 лет 14 апреля 2003 года покинула Любовь Трофимовна Малая, Герой Украины, Герой Социалистического Труда, кавалер ордена Трудового Красного Знамени; орденоносец..
| Лекарственная безопасность
лекарства лекарственная безопасность лекарственные препараты лекарственная реакция реакция пациента на лекарственные препараты летальные исходы
Лекарственная безопасность
С. Панчук, Н. Яблучанский
Редакция Medicus Amicus
Лекарственная безопасность является одним из приоритетных направлений современной медицины и фармации. Её актуальность определяется динамическим ростом фарминдустрии, обеспечивающим создание и продвижение на рынок огромного количества новых медикаментов; мощными биологическими эффектами лекарственных средств,
способных существенно модифицировать структурно-функциональные взаимоотношения органов и систем человеческого организма; повышением сенсибилизации пациентов к химическим и биологическим веществам в результате полипрагмазии, применения недоброкачественных медикаментов (нарушение правил их хранения, использование подделок, которые содержат плохо очищенные субстанции, токсичные наполнители и т.п.); ростом числа случаев развития у пациентов тяжелых осложнений фармакотерапии, требующих не только экстренных госпитализаций, но и являющихся причиной летальных исходов.
В Украине процессы формирования современной системы фармакологического надзора (лекарственного мониторинга) только завершаются, поэтому статистические данные, характеризующие медико-социальную значимость лекарственной безопасности, находятся на этапе сбора и первичного анализа.
В развитых странах с высоким уровнем здравоохранения и отлаженной системой контроля безопасности применения лекарственных средств, неблагоприятные эффекты фармакотерапии, как основная причина госпитализации, составляют внушительный процент (Англия - 16%, Франция 13%, Норвегия 11,5%, США 6-7%). Только в США ежегодные затраты, связанные с осложнениями медикаментозной терапии, достигают 70 миллиардов долларов. Побочное действие или неправильное назначение лекарственных средств в этой стране ежегодно является причиной более чем 100 000 смертей.
История
Контроль государством обращения лекарств, как компонент системы лекарственной безопасности, существовал еще в Древней Греции и Египте, в I тысячелетии до нашей эры. За назначение лекарства, которое обладало свойствами яда, врачи Древней Греции лишались рук.
В средние века II тысячелетия нашей эры во многих государствах правом проверки аптекарских товаров и уничтожения некачественной продукции обладали члены признанных медицинских сообществ.
Принципиально новая форма контроля качества лекарственных средств - Фармакопея впервые появилась в XVII веке на территории Великобритании. Вначале были созданы локальные фармакопеи (Лондонская, Эдинбургская), содержащие официально утвержденные перечни лекарственных средств с инструкциями по их приготовлению.
В 1864 году увидела свет Британская фармакопея - первый документ с приведенными к единому стандарту требованиями, предъявляемыми к качеству лекарственных средств и правилам их назначения.
В конце XIX начале XX века во многих странах мира стали формироваться государственные структуры, контролирующие вопросы лекарственной безопасности.
В 1906 году в США был принят первый закон (Food and Drugs Act), который защищал потребителей от незаконного распространения на территории страны несертифицированных и фальсифицированных продуктов,
напитков и лекарств. С этого года ведет отсчет своей истории известнейшая в мире государственная структура - Управление по контролю качества пищевых продуктов и лекарственных средств США, или U.S. Food and Drug Administration (FDA).
Значимость этой организации в жизни населения страны становится понятной хотя бы из того, что на сегодня 25 центов из каждого истраченного американцем доллара приходится на продукцию, качество которой контролирует FDA.
В Великобритании в 1925 году был издан закон "О терапевтических субстанциях", контролирующий чистоту биологических препаратов и регламентирующий систему лицензирования производителей (предварительная инспекция предприятий, проверка квалификации персонала и качества ведения документации, др.). В это же время приняты первые требования к маркировке медикаментов, согласно которым обязательными ее атрибутами становились название фирмы-производителя и номер произведенной партии.
Повышению внимания государств к проблеме лекарственной безопасности способствовали периодически регистрируемые случаи массового токсического действия лекарств: внезапная смерть при проведении анестезии хлороформом (1877 год), острая печеночная недостаточность со смертельным исходом на фоне применения препаратов мышьяка (20-е годы XX века).
В 1937 году в США зафиксировано 107 случаев со смертельным исходом, преимущественно среди детей, употреблявших эликсир сульфаниламида, в котором для обеспечения растворимости антибактериального средства в воде использовалось токсическое вещество, сходное по химической структуре с компонентом антифриза.
Эта трагедия вскрыла несовершенство существовавшего закона, не требующего от производителей контроля безопасности составляющих лекарственное средство компонентов перед выпуском его на фармацевтический рынок. В 1938 году в новом законодательном акте "Federal Food, Drug and Cosmetic Act" компании-производители обязывались документально подтверждать безопасность выпускаемого лекарственного средства перед его использованием в медицинской практике.
Еще более масштабная трагедия, обусловленная токсическим действием лекарственного средства, произошла в 60-е годы. Женщины по всему миру в ранние сроки беременности применяли обладающий выраженным тератогенным эффектом талидомид. Это повлекло за собой рождение около 25000 детей, треть которых живы и поныне, с уродствами конечностей (гипоплазия и аплазия). В оказании помощи пострадавшим по комплексу медико-социальных вопросов участвует ассоциация жертв талидомида.
Многие страны внесли соответствующие изменения в законы и сформировали национальные Центры по контролю лекарственной безопасности. Так, в 1963 году в Великобритании был образован Комитет по безопасности лекарств (Committee on Safety of Drugs), состоящий из экспертов - медиков, фармацевтов, фармакологов, токсикологов и статистических работников. А в 1968 году принят законодательный акт "О лекарственных средствах" (Medicines Act), в котором качество, безопасность и эффективность лекарственного средства рассматривались как обязательные составляющие, определяющие выдачу разрешения для его использования в клинической практике.
В настоящее время контроль за безопасностью медикаментов в Великобритании обеспечивает созданное путем реорганизации ранее существовавших структур Агентство по контролю за лекарственными средствами (the United Kingdom Medicines Сontrol Agency - MCA).
В 1968 году в рамках существовавшего СССР в Министерстве здравоохранения (МЗ) был создан специальный отдел, трансформировавшийся в последующем во Всесоюзный центр по изучению побочных действий лекарств.
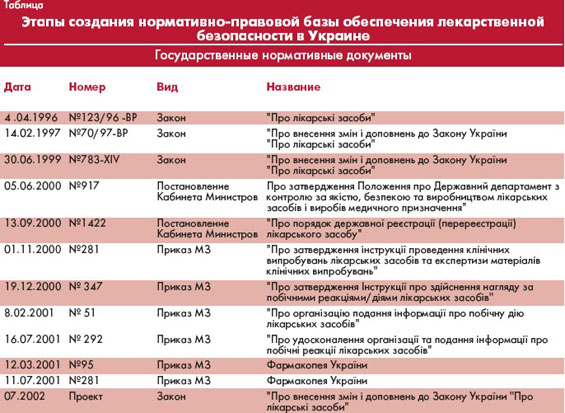
С момента образования в 1996 году Центра побочного действия лекарственных средств в Украине начали восстанавливаться органы контроля лекарственной безопасности. В настоящее время Центр трансформирован в отдел фармакологического надзора "Государственный фармакологический центр" (ГФЦ) МЗ Украины. На сегодня в стране практически завершено формирование нормативно-правовой базы обеспечения лекарственной безопасности (табл.).
Программа международного мониторинга лекарственных препаратов, призванная объединить работу национальных Центров лекарственной безопасности, была инициирована ВОЗ в середине 60-х годов прошлого века. При ней был создан специальный Центр с аналогичным названием, куда из самых разных источников стала поступать информация, касающаяся безопасного применения медикаментов.
На первых этапах Программой международного мониторинга лекарственных препаратов было охвачено 22 страны, сейчас - около 60, что явно недостаточно. Основная причина - для включения страны в Программу должны быть проведены серьезные организационные мероприятия на государственном уровне. С 2001 года Украина является ассоциированным членом Программы международного мониторинга лекарственных препаратов, участие в которой позволяет оперативно реагировать на появление на мировом фармацевтическом рынке не вполне безопасных медикаментов. За весь период ее реализации многие потенциально опасные лекарства либо изымались, либо существенно ограничивалось их применение.
Обеспечение
Создание лекарственного средства, лишенного неблагоприятных эффектов, является хотя и желаемой, но невыполнимой задачей. Поэтому в выборе того или иного лекарственного средства практикующий врач должен, прежде всего, ориентироваться на его безопасность, определяемую по соотношению пользы и риска от его применения у конкретного пациента. Указанную информацию можно почерпнуть непосредственно из документов Центра международного мониторинга лекарственных препаратов и национальных Центров по контролю лекарственной безопасности, на сайтах, например таких: www.fda.gov, www.drugsafety.com, www.safety.com и др.
Дополнительно в выборе безопасных лекарственных средств врач может руководствоваться международными (национальными) стандартами лечения соматических заболеваний и синдромов, поскольку они, как правило, базируются на результатах хорошо организованных, проспективных, рандомизированных, плацебоконтролируемых клинических исследований.
Среди факторов, определяющих выбор лекарственного средства врачом, и особенно пациентом, существенную роль играет реклама, на которую ежегодно расходуется более 12 миллиардов долларов. Для стран с низким доходом на душу населения специфическим фактором, детерминирующим выбор врачом и пациентом лекарственного средства, является его стоимость.
По существующим международным стандарт ам, обеспечение безопасности лекарственного средства есть процесс, начинающийся с момента его разработки, синтеза, лабораторных, клинических испытаний, и продолжающийся (в случае получения допуска) непрерывным мониторингом в течение всего периода нахождения на фармацевтическом рынке. В нем участвуют не только компания-производитель, соответствующие контролирующие государственные и международные структуры, но и научно-исследовательские институты, клиники, проводящие испытания, а также практикующие врачи.
В качестве главного критерия, определяющего как допуск лекарственного средства на фармацевтический рынок, так и его успешное практическое применение, выступает показатель риск/польза. Для достижения его оптимального (целевого) значения в мире используется этапный подход в оценке безопасности лекарственных средств.
На подготовительном (теоретическом) этапе проводится расчет предполагаемых фармакологических эффектов "кандидата" на лекарственное средство в соответствии с его химической структурой и при сопоставлении с аналогичными уже имеющимися субстанциями. На следующем этапе выполняются лабораторные исследования (на образцах тканей и in vitro) по обнаружению предполагаемых и поиску непрогнозируемых (неожиданных) эффектов. Этап исследований на лабораторных животных возможен лишь в случае успешности (выявления у тестируемой субстанции потенциальных фармацевтических свойств) первых двух.
На животных отрабатывается экспериментальная модель влияния лекарственного средства на физиологические параметры органов и систем с последующим тщательным анализом полученных результатов (в плане возможного их проецирования на человека). При получении достаточного количества достоверных данных,
подтверждающих наличие у исследуемого соединения приемлемого соотношения риск/польза, переходят к исследованиям на людях. Исследования на людях также складываются из нескольких этапов (фаз). На первом этапе (phase I) лекарство апробируется на небольшом (менее 10 человек) количестве добровольцев.
При этом осуществляется тщательный мониторинг физиологических реакций включенных в исследование лиц при назначении им минимальной однократной дозы и доз, вызывающих как ожидаемые (лечебные),
так и нежелательные патологические реакции организма. Любое изменение дозировки и схемы введения лекарственного средства предварительно тщательно отрабатывается на лабораторных животных. Цель этапа - изучить степень безопасности назначения лекарственного средства. На втором этапе (phase II) клинических испытаний в исследование включают 30-40 пациентов, имеющих заболевание (симптом), в лечении которого планируется использовать лекарственное средство.
Цель этапа - определение терапевтической эффективности лекарственного средства. Появление как минимум у каждого пятого пациента верифицированного положительного эффекта от назначаемого лекарственного средства является основанием для признания данного этапа испытаний успешным, при условии отсутствия
серьезных неблагоприятных реакций. Третий этап (phase III) - собственно оценка эффективности и безопасности будущего лекарственного препарата в соответствии с предполагаемыми показаниями по его применению на выбранных категориях пациентов. Количество включаемых в исследования этого этапа пациентов, а также продолжительность во многом определяются природой лекарственного средства, его предполагаемыми показаниями к применению.
Как правило, исследования длятся не менее 6 месяцев и охватывают тысячи пациентов в различных центрах. Обязательным условием данного этапа является выделение, как минимум, двух групп пациентов. В контрольной группе пациенты получают плацебо или стандартную (принятую на момент проведения исследования) терапию,
в другой - новое лекарственное средство. После завершения клинических испытаний вся полученная на предыдущих этапах информация систематизируется в брошюре исследователя, которая подается в национальный Центр контроля лекарственной безопасности. Его сотрудники, проанализировав информацию об эффективности и безопасности лекарственного средства, принимают решение о допуске его на национальный фармацевтический рынок.
В дальнейшем фирма-производитель вместе с национальными контролирующими структурами и Центром международного мониторинга лекарственных препаратов осуществляют непрерывное наблюдение за безопасностью его применения в клинической практике, анализируя любую информацию о возникшей неожиданной неблагоприятной лекарственной реакции.
Выделяют 4 основных типа реакций:
- Tип "A" - дополнительные, но обусловленные фармакологически ожидаемой активностью лекарственного средства, реакции, потенциально определяемые на любом из доклинических этапов его изучения. Их основные свойства - зависимость от дозы, ординарность, низкие заболеваемость и смертность.
- Tип "B" - странные, непредсказуемые и достаточно редкие (ежегодная частота встречаемости - менее чем 1:1000) реакции, обусловленные преимущественно гиперреактивностью организма, в том числе и генетически детерминированной. Как правило, они дозонезависимые, но характеризуются высокой заболеваемостью и смертностью.
- Tип "C" - реакции, в основе которых лежат эффекты лекарственного средства на фоне его длительного использования.
- Tип "D" - редкие, отсроченные во времени реакции организма на имевший место в прошлом прием лекарственного средства.
Наибольшие сложности возникают в верификации реакций трех последних типов. Для обнаружения реакций типа "В" необходимы популяционные исследования, охватывающие миллионы пациентов. Определение реакций "С" и "D" типов затрудняется отсутствием единой методологии исследования, ошибками, возникающими при обнаружении и описании (трактовке) реакции. Наличие у части пациентов фоновых (сопутствующих) заболеваний также способствует снижению вероятности их определения.
Залогом эффективности Программы международного мониторинга лекарственных препаратов является достаточно гибкая и простая система подачи и поступления информации в соответствующие национальные и международные структуры. Обнаружение медиком и/или фармацевтом возможной причинно-следственной связи между приемом лекарственного
средства и неизвестным неблагоприятным эффектом является основанием для подачи "аварийного сигнала": публикация материалов клинических испытаний, научных статей, эпидемиологических исследований. Возможен и прямой доступ через Internet непосредственно на сайты этих организаций.
В Великобритании используется специальная форма "аварийного сигнала" - "желтая карта", которую врач добровольно может заполнить и направить в МCA, фирме-производителю и в Центр международного мониторинга лекарственных препаратов.
В Украине, в соответствии с рекомендациями ВОЗ, Европейского Союза и Совета Европы, поступление информации о фактах неблагоприятной реакции в результате применения лекарственного средства в отдел фармакологического надзора ГФЦ организуется по четырем независимым каналам.
Первый канал. "Сообщение о побочных реакциях лекарственных средств", или форма № 137, заполняется в соответствии с инструкцией, утвержденной приказом МЗ Украины № 347 от 19.12.2000 г. (регистрация в Министерстве юстиции Украины за № 947/5168 от 26.12.2000 г.). Срок направления формы №137 в отдел фармакологического надзора ГФЦ определяется характером выявленной неблагоприятной реакции лекарственного средства. В случае серьезной неблагоприятной лекарственной реакции он составляет 2 суток от момента выявления, в остальных случаях - 15 суток.
Второй канал. "Отчет о случаях побочной реакции/действия лекарственных средств в лечебно-профилактических учреждениях", или форма № 69-здоров, ежегодно (до 30 января) подается в отдел фармакологического надзора ГФЦ руководителями областных отделов здравоохранения, Автономной Республики Крым, Главных управлений здравоохранения Киевской и Севастопольской городских государственных администраций.
Этот отчет составляется на основании аналогичных отчетов руководителей всех лечебно-профилактических учреждений по данным карты стационарного больного, выписки из карты стационарного больного и амбулаторной карты. Во всех этих документах врачи впервые в медицинской практике будут делать статистическую отметку о наличии побочной (неблагоприятной) реакции в результате применения лекарственного средства. Эта информация должна помещаться в ту же графу, что и диагноз заболевания (Приказ МЗ Украины №292 от 16.07.2001 г.).
Третий канал. Информация производителя лекарственного препарата в отдел фармакологического надзора о всех неблагоприятных реакциях, развивающихся в результате применения данного лекарства: в течение первых двух лет после регистрации в Украине - два раза в год, в последующие 3 года - один раз в год и уже только новые данные. В развитых странах лекарственный мониторинг принято проводить в течение 15 лет с момента появления лекарственного препарата на фармацевтическом рынке.
Четвертый канал. Результаты клинических исследований как инструмент выявления неожиданных неблагоприятных лекарственных реакций, сравнения клинической эффективности и безопасности различных препаратов. Результаты фармако-эпидемиологических исследований как объективный показатель этнического, возрастного, полового и иного распределения случаев неблагоприятных лекарственных реакций.
Если поступающих сигналов о неблагоприятной реакции конкретного лекарственного препарата становится достаточно много и представленная информация имеет высокую степень достоверности, структуры, ответственные за лекарственную безопасность, обязаны отреагировать.
Возможные виды реагирования:
- дополнительные целенаправленные исследования или специализированный мониторинг оценки значимости поступившей информации;
- внесение в инструкцию по применению лекарственного препарата дополнительной информации, указывающей на выявленные неблагоприятные лекарственные реакции с перечислением факторов, предрасполагающих к их появлению, и/или групп риска, а также предупреждающей пациентов о необходимости отслеживания
появления указанных реакций и информирования специалистов. Дополнительно издается распространяемый среди медиков и фармацевтов информационный листок;
- ограничение использования лекарственного препарата, если соотношение риск/польза это позволяет;
- отзыв лекарственного препарата с рынка или запрет на его использование.
Таким образом, на сегодня сформированы и эффективно действуют многие национальные и международные структуры, обеспечивающие лекарственную безопасность достаточно большой части населения планеты. Их деятельность является важным контролирующим и сдерживающим фактором для проникновения на фармацевтический рынок потенциально опасных лекарственных средств. Она же оказывается чувствительным инструментом выявления неожиданных неблагоприятных лекарственных реакций в процессе клинического применения разрешенных медикаментов.
Мировой опыт показывает, что наряду с контролирующими структурами и фирмами-производителями ключевым звеном системы обеспечения лекарственной безопасности является практикующий врач.
Его информированность в этих вопросах, неравнодушие и активная жизненная позиция - важные составляющие безопасной фармакотерапии.
В условиях завершения в Украине структурно-правового обеспечения лекарственной безопасности ознакомление с ним как можно более широкого круга врачей является весьма актуальным.
Пристальный лекарственный мониторинг со стороны врача-практика может позитивно отразиться и на национальных производителях лекарственных средств, стимулируя разработку и изготовление ими более безопасных и конкурентоспособных отечественных медикаментов. Кроме того, возникнут предпосылки для уменьшения вероятности применения на рынке Украины и небезопасных импортных лекарственных средств.
Главное, в выигрыше будет население страны, поскольку, наряду со здоровым образом жизни, использование высокоэффективных и безопасных лекарственных средств - залог уменьшения заболеваемости и смертности, продления активного долголетия и улучшения других показателей, характеризующих здоровье нации.
Термины
Лекарственные средства (лекарственные препараты, лекарства, медикаменты) - вещества или их смеси естественного, синтетического или биотехнологичного происхождения, которые используются для профилактики, диагностики и лечения заболеваний, изменения состояния или физиологических функций организма.
К лекарственным средствам относят:
- готовые лекарственные средства, которые получены путем технологической обработки субстанций, вспомогательных веществ, растительного лекарственного сырья, прошли стадии технологического процесса, а также контроль качества в том виде и состоянии, в котором применяются человеком, упакованные и маркированные соответствующим образом;
- активные вещества (субстанции, действующие вещества, биологические агенты) естественного (человеческого, животного, микробного, растительного, минерального), искусственного или биотехнологического происхождения, обладающие фармакологическим или иммунологическим действием и предназначенные для производства и изготовления готовых лекарственных средств;
- дезинфекционные или инсектицидные средства, с которыми имеется непосредственный контакт человека;
- медицинские иммунобиологические препараты, преимущественно биологического происхождения, в том числе крови и ее компонентов, а также тканей человека и животных, предназначенные для использования в медицинской практике с целью специфической профилактики, лечения и диагностики инфекционных, в том числе паразитарных, заболеваний и аллергических состояний;
- радиоактивные фармацевтические средства;
- гомеопатические средства, содержащие одну или несколько субстанций и изготовленные методом последовательного разведения или дисперсии;
- состоящие из лечебных растений лекарственные чаи;
- лечебные добавки к пищевым продуктам - естественные или синтетические биологически активные вещества, предназначенные для введения (или введенные) в состав пищевого продукта для получения
профилактического и /или лечебного эффекта в терапии конкретного заболевания в количествах, превышающих физиологическую потребность;
- лечебные косметические средства, содержащие субстанцию или смесь веществ естественного или искусственного происхождения, предназначенные для лечения или профилактики заболеваний кожи, ее придатков
(волос, ногтей, ресниц и т.п.), слизистой оболочки ротовой и носовой полостей, наружных половых органов и т.д.;
- диагностические препараты, в том числе используемые в выявлении возбудителей заболеваний;
- лекарственное растительное сырье.
Продукция, не являющаяся лекарственным веществом, в маркировании которой запрещено приводить лечебные показания:
- биологически активные добавки,
- пищевые продукты,
- косметические средства,
- материалы для лабораторной диагностики, с которыми нет контакта органов человека,
- изделия медицинского назначения, медицинская техника и комплектующие, дезинфекционные или инсектицидные средства, не относящиеся к лекарственным средствам.
Лекарственная безопасность (лекарственный мониторинг, фармакологический надзор) - мультидисциплинарное (по разным направлениям медицины и фармации) непрерывное отслеживание, распознавание и реагирование на потенциальную или реальную проблему, возникающую в ответ на применение фармакологического средства.
Безопасность лекарственных средств - характеристика лекарственных средств, основанная на сравнительном анализе их эффективности и оценки риска причинения вреда здоровью человека.
Неблагоприятный эффект лекарственного средства - любой случай появления непредвиденного симптома, синдрома (клинического и/или лабораторного), заболевания, возникших в медицинской практике у пациента при его назначении. Доказанная причинно-следственная связь неблагоприятного эффекта с проводимым лечением или клиническим испытанием не обязательна.
Неблагоприятная лекарственная реакция:
- на лекарственное средство с неустановленным терапевтическим диапазоном доз, проходящее доклиническое испытание как новый продукт или с целью расширения показаний к использованию, - все непрогнозируемые вредные для организма пациента реакции, возникающие в ответ на его прием в любой дозировке. Доказанная связь между приемом лекарственного средства и неблагоприятной реакций не обязательна;
- на лекарственное средство, разрешенное для клинического применения,
- любая непрогнозируемая вредная для организма пациента реакция в ответ на применение в дозах, предназначенных для профилактики, диагностики, лечения заболеваний или же для изменения физиологических функций пациента.
Возможная или ожидаемая неблагоприятная лекарственная реакция - реакция, природа и тяжесть которой известны и внесены в прилагаемую к лекарственному средству инструкцию по применению, а в случае проходящих доклиническое испытание лекарственных препаратов - в специальный фармакологический документ, брошюру исследователя.
Неожиданная неблагоприятная лекарственная реакция - реакция, природа и тяжесть которой не внесены в прилагаемую к лекарственному средству инструкцию по применению, а в случае проходящих доклиническое испытание лекарственных препаратов - в брошюру исследователя.
Серьезный (-ая) неблагоприятный (-ая) эффект (лекарственная реакция) - любой случай применения лекарственного средства независимо от его дозировки, повлекший за собой одно из последствий:
- смерть пациента,
- развитие жизненно опасной ситуации,
- экстренную госпитализацию или увеличение сроков стационарного лечения,
- стойкую или значительную утрату трудоспособности и/или дееспособности,
- появление врожденной аномалии (дефекта) у потомства.
Замена термина "серьезный" на "тяжелый" нецелесообразна из-за различий в смысловой нагрузке: "серьезный" - значимый по последствиям для организма, а "тяжелый" - критерий выраженности, но не значимости чего-либо.
Побочный эффект лекарственного средства - термин, в настоящее время редко используемый в зарубежной литературе в контексте лекарственной безопасности и не отождествляемый с терминами "неблагоприятный эффект", "неблагоприятная лекарственная реакция", так как имеет неоднозначную трактовку (может быть как отрицательным, так и положительным для конкретного пациента).
Показатель риск/польза лекарственного средства - соотношение риска ухудшения здоровья пациента к ожидаемому положительному эффекту от его применения.
Целевой (оптимальный) показатель риск/польза лекарственного средства - такое соотношение, при котором минимальный риск ухудшения здоровья пациента сочетается с максимальной пользой от его применения.
Минимальный риск лекарственного средства - такой риск, при котором угроза здоровью пациента при его применении приближается к той, которая существует в повседневной жизни при проведении рутинных физикальных и психологических исследований и тестов.
Medicus Amicus 2002, #5
Medicus Amicus 2002, #6
Medicus Amicus 2003, #1
|
|














 Новости
Новости 