Исследование биоэквивалентности препарата тридуктан мв оригинальному триметазидину 35мг с модифицированным высвобождением активной субстанции
Удовиченко М.М., Педан Н.В., Пивовар С.Н., Лозик Т.В., Рудык Ю.С., Либина В.В., Орлова И.Н., Кириенко Я.С.
ГП «Институт терапии им. Л.Т.Малой АМН Украины»
ГП «Государственный научный центр лекарственных средств»
Резкое увеличение расходов на здравоохранение в последние годы поставило новую задачу – выбор способа лечения, который оптимально сочетает в себе клиническую эффективность, безопасность и стоимость. Генерики с подтвержденной биоэквивалентностью представляют собой надежную и недорогую альтернативу препаратам-брендам. Отчетливая тенденция развития фармацевтических рынков Украины и Российской Федерации - увеличение доли генерических препаратов (по различным данным, эта цифра колеблется от 78 до 95%). Для сравнения, на рынках стран "большой семерки" они занимают: в США - 12%, Японии - 30%, Германии - 35%, Франции - 50%, Англии - 55%, Италии - 60%, Канаде - 64%. Но без исследования биоэквивалентности совершенно неприемлемо заменять одно лекарство другим только на том основании, что они имеют одинаковый химический состав и ингредиенты. Именно поэтому в настоящее время основным методом определения качества лекарств в странах Европейского Союза, США и многих других странах является биоэквивалентность.
Биоэквивалентность, основанная на одинаковой биодоступности генерического и эталонного (оригинального) лекарственного препарата для внесосудистого (непарентерального) введения (прием внутрь или под язык, накожная аппликация и др.), может быть установлена только при помощи проведения контролируемых перекрестных клинических исследований.
Наиболее широкое использование генериков наблюдается при социально значимых заболеваниях, имеющих большую распространенность (ИБС, АГ, ХСН, и др.). В этой связи добиться изменения течения и исхода социально значимых заболеваний можно только используя относительно доступные и высококачественные генерики.
Несмотря на достигнутые в последние десятилетия успехи в профилактике и лечении ИБС, она по-прежнему представляет собой одну из наиболее актуальных проблем современной кардиологии.
В последнее время активное развитие получила концепция метаболического подхода к терапии ИБС, основанная на коррекции метаболизма в ишемизированном участке миокарда, непосредственно связанного с патогенезом ИБС. Именно такой фармакологический подход получил наибольшее распространение в метаболической терапии ИБС. К наиболее изученным и широко применяемым в клинической практике препаратам этой группы относится триметазидин.
Новая улучшенная лекарственная форма – триметазидин с модифицированным высвобождением (МВ) – обеспечивает более надежный антиишемический и антиангинальный контроль в течение 24 часов. В Украине генерический препарат триметазидина МВ – Тридуктан МВ, таблетки, покрытые оболочкой, с модифицированным высвобождением активной субстанции, разработан ООО «Фарма Старт».
Целью данной работы явилась оценка биоэквивалентности препаратов Тридуктан МВ, таблетки, покрытые оболочкой, с модифицированным высвобождением активной субстанции, 35 мг производства ООО «Фарма Старт» (Украина) и оригинального препарата, таблетки, покрытые оболочкой, с модифицированным высвобождением активной субстанции, 35 мг методом сравнительного изучения их биодоступности.
Исследование проведено на базе отдела клинической фармакологии и фармакотерапии ГУ «Институт терапии им. Л.Т.Малой АМН Украины» и лаборатории экспериментальной фармакокинетики, биоэквивалентности и токсикокинетики ГП «Государственный научный центр лекарственных средств».
Субъекты, материалы и методы исследования
Данное исследование проведено в соответствии с требованиями Министерства здравоохранения Украины [7,8] и принципами Хельсинской Декларации, ICH-GCP и действующим законодательством Украины. Протокол исследования одобрен Комиссией по вопросам этики Министерства здравоохранения Украины и комитетом по биоэтике ГУ “Институт терапии им. Л.Т.Малой АМН Украины”.
В исследование включено 18 здоровых добровольцев (10 мужчин и 8 женщин); возраст добровольцев составлял от 18 до 43 лет (средний возраст – 25,1±6,6 года);
Добровольцы не принимали других лекарственных средств в течение 7 дней до начала исследования и на протяжении всего периода исследования до полного его завершения.
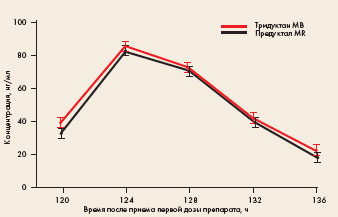 Рис. Усредненные фармакокинетические кривые триметазидина в плазме крови здоровых добровольцев после повторного приема препаратов Тридуктан МВ и Предуктал MR
-•- Тридуктан МВ -о- Предуктал MR
Исследуемые препараты:
Тестируемый препарат - Тридуктан МВ, таблетки, покрытые оболочкой, с модифицированным высвобождением активной субстанции, 35 мг производства ООО «Фарма Старт» (Украина);
Референтный препарат (препарат сравнения) - оригинальный препарат триметазидин 35 мг с модифицированным высвобождением.
Дизайн исследования:
Исследование проведено путем определения концентраций триметазидина в плазме крови здоровых испытуемых после однократного приема суточной дозы – 2 таблетки (по 35 мг) и многократного приема разовой дозы каждого из сравниваемых препаратов в соответствии со схемой, установленной инструкцией по медицинскому применению, – по 1 таблетке (35мг) 2 раза в сутки (каждые 12 часов) в течение 4 суток до установления стационарной концентрации триметазидина в крови.
Распределение добровольцев на 2 группы осуществлялось согласно рандомизационной схеме Протокола исследования: в I периоде исследования добровольцы, вошедшие в I группу, принимали препарат Тридуктан МВ; добровольцы II группы – оригинальный препарат. Во II периоде исследования добровольцы I группы принимали оригинальный препарат; добровольцы II группы – Тридуктан МВ.
Препараты считаются биоэквивалентными, если 90-процентный доверительный интервал для отношения средних логарифмически преобразованных значений AUC0-t и Сmax находится в пределах 0,80 - 1,25.
Результаты
Усредненные фармакокинетические кривые, полученные на основании результатов определения концентрации триметазидина в плазме крови добровольцев при курсовом приеме препаратов (по 1 таблетке 35 мг 2 раза в сутки каждые 12 часов в течение 4 суток), стационарная плазменная концентрация триметазидина устанавливается на 3-4-е сутки. Как видно на рисунке, после установления стационарной концентрации уровень триметазидина перед приемом очередной дозы сравниваемых препаратов составляет, в среднем, 30-40 нг/мл, тогда как максимальные значения лежат в диапазоне 80-85 нг/мл.
После приема испытуемого препарата (Тридуктан МВ) и референтного препарата у 18 здоровых добровольцев на протяжении всего периода исследования не наблюдалось развития побочных реакций/явлений.
Выводы:
- Испытуемый препарат Тридуктан МВ, таблетки, покрытые оболочкой, с модифицированным высвобождением активной субстанции, 35 мг производства ООО «Фарма Старт» (Украина) биоэквивалентен референтному препарату Предуктал МR, таблетки, покрытые оболочкой, с модифицированным высвобождением активной субстанции, 35 мг производства «Лаборатории Сервье» (Франция).
- После однократного приема 2 таблеток (70 мг) препаратов Тридуктан МВ и Предуктал МR и многократного приема по 1 таблетке (35мг) 2 раза в день у здоровых добровольцев побочных реакций не наблюдалось.
Medicus Amicus
|

















 Новости
Новости 