Современные методы терапии сахарного диабета 2 типа
По определению экспертов Всемирной Организации Здравоохранения: «Сахарный диабет является проблемой всех возрастов и всех стран». В настоящее время сахарный диабет (СД) занимает третье место среди непосредственных причин смерти после сердечно–сосудистых и онкологических заболеваний, поэтому решение многих вопросов, связанных с этим заболеванием, поставлено во многих странах мира на государственный, федеральный уровень [1].
Мо мнению Международного Экспертного Комитета по диагностике и классификации сахарного диабета (1997), сахарный диабет – группа метаболических нарушений, характеризующихся гипергликемией, которая является результатом дефектов секреции инсулина, действия инсулина или сочетание обоих этих факторов.
Управление
сахарным диабетом 2 типа
В настоящее время во всем мире накоплены доказательства того, что эффективный контроль диабета может свести до минимума или предотвратить многие из связанных с ним осложнений.
В отношении эффективного управления СД существуют убедительные доказательства, свидетельствующие, что улучшение гликемического контроля может значительно уменьшить риск развития как микро–, так и макроангиопатии.
Анализ 10–летнего исследования DCCT (Контроль за диабетом и его осложнениями) показал, что на каждый процент снижения гликированного гемоглобина риск развития микрососудистых осложнений (ретинопатии, нефропатии) снижался на 35%. Кроме того, результаты данного исследования четко продемонстрировали, что агрессивный контроль гликемии наряду с нормализацией показателей артериального давления значительно снижает риск развития ишемической болезни сердца, цереброваскулярных заболеваний и периферической ангиопатии у больных сахарным диабетом 2 типа. Исходя из этого, основной целью лечения болезни является как можно более полная компенсация нарушений углеводного обмена. Только применение комплексной и патогенетически обоснованной терапии, учитывающей хроническое течение заболевания, гетерогенность метаболических нарушений, прогрессирующее снижение массы β–клеток, возраст больных и опасность гипогликемий, а также необходимость восстановления нарушенной секреции инсулина и достижение эффективного долгосрочного гликемического контроля позволит достичь этой цели.
На сегодняшний день вылечить сахарный диабет 2 типа невозможно, но им можно хорошо управлять и жить полноценной жизнью.
В программу управления сахарным диабетом 2 типа включают следующие способы решения главных задач:
• изменение образа жизни (диетотерапия, физические нагрузки, уменьшение стресса);
• медикаментозное лечение (пероральные сахароснижающие препараты, инкретиномиметики, инсулинотерапия).
Несмотря на многочисленные печатные работы по управлению сахарным диабетом 2 типа, изданные в последнее время, не все врачи владеют алгоритмом лечения этого тяжелого заболевания. В настоящее время разработано и опубликовано пересмотренное Согласованное Постановление Американской Диабетической Ассоциации (ADA) и Европейской Ассоциации по изучению сахарного диабета (EASD), касающееся управления гипергликемией при сахарном диабете 2 типа [4].
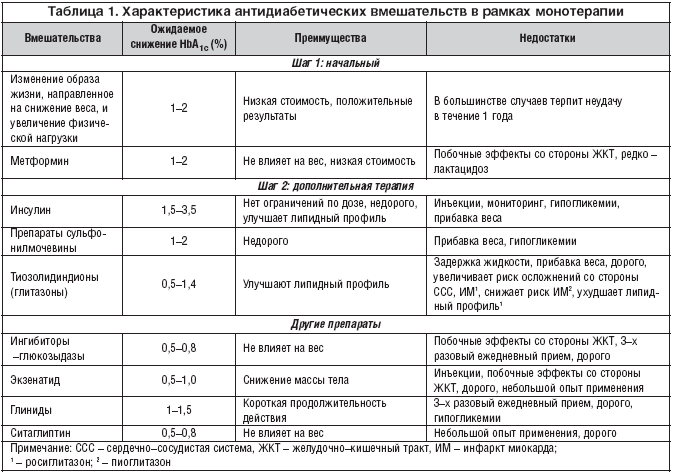
В таблице 1 представлены различные современные антидиабетические вмешательства, с учетом их эффективности, преимуществ и недостатков.
Цели терапии
Принципиально важным моментом являются объективные цифровые критерии компенсации сахарного диабета 2 типа. В 1999 году было опубликовано руководство по оказанию помощи больным сахарным диабетом 2 типа, в котором представлены критерии компенсации заболевания. Важно обратить особое внимание на необходимость более жесткого контроля не только углеводного обмена, но и липидного, а также показателей артериального давления через призму сосудистого риска, или риска развития фатальных сосудистых осложнений сахарного диабета 2 типа (табл. 2–4).
Выбор терапии и ее роль в лечении сахарного диабета 2 типа
Многочисленные исследования во всем мире сосредоточены на поиске эффективных средств лечения сахарного диабета. Однако не стоит забывать, что помимо медикаментозной терапии не менее важны и рекомендации по изменению образа жизни.
Основные принципы диетотерапии
• дробное сбалансированное питание 6 раз в сутки, небольшими порциями, в одно и тоже время, что способствует поддержанию веса в пределах нормы и предотвращает резкие постпрандиальные перепады уровней гликемии
• при избыточной массе тела показана низкокалорийная диета (≤1800 ккал)
• ограничение простых, легкоусвояемых углеводов (сахар и продукты его содержащие, мед, фруктовые соки)
• увеличение потребления богатой клетчаткой пищи (от 20 до 40 г в сутки)
• ограничение употребления насыщенных жиров ‹<10%, полиненасыщенных ‹<10%; предпочтение следует отдавать мононенасыщенным жирам
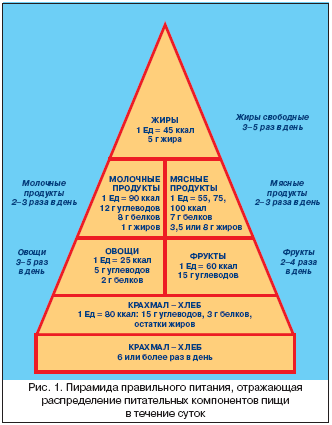
• суточное количество белка в пище должно составлять 1,0–0,8 г/кг массы тела, при патологии почек это количество следует уменьшить (рис. 1)
• ограничение употребления соли до 3 г в сутки, из–за высокого риска развития артериальной гипертензии, нефропатии. Следует учитывать, что в суточном количестве неподсоленных продуктов уже содержится 1,5–2,0 г соли
• ограничение употребления алкоголя с учетом высокой калорийности и риска развития гипогликемии (<30 г в сутки)
• диета должна быть богата витаминами и содержать необходимое количество микроэлементов. В зимне–весеннее время рекомендуется прием таблетированных поливитаминов [2,3].
Физические нагрузки в лечении
сахарного диабета 2 типа
Пациентам с сахарным диабетом 2 типа рекомендуются ежедневные однотипные дозированные физические нагрузки: пешие прогулки на свежем воздухе, плавание, езда на велосипеде и др.
Вид физической нагрузки, ее интенсивность, длительность и частота должны быть индивидуально подобраны для каждого пациента с учетом возраста, исходной физической активности, общего состояния пациента, наличием осложнений диабета и сопутствующих заболеваний (рис. 2).
Важно отметить, что физические нагрузки не только положительно влияют на показатели гликемии, способствуя утилизации глюкозы (причем этот эффект сохраняется еще в течение нескольких часов после окончания физических упражнений), но и улучшают липидный обмен (снижают уровень триглицеридов, способствующих развитию микроангиопатии, и повышают уровень липопротеидов высокой плотности, препятствующих развитию атеросклероза), а также положительно влияют на свертывающую систему крови (повышают фибринолитическую активность и снижают вязкость крови, агрегацию тромбоцитов и уровень фибриногена).
Помимо этого, физические упражнения благотворно влияют на сердечно–сосудистую систему: повышают эффективность сердечного выброса, способствуют электрической стабильности миокарда, снижают потребление кислорода сердечной мышцей, снижают и стабилизируют артериальное давление, улучшают кровообращение в мышцах.
Не менее важно, что физические нагрузки вызывают положительные эмоции и помогают противостоять стрессовым ситуациям, приводят к благоприятным гормональным изменениям: снижают уровень гормонов стресса, повышают уровень «гормонов удовольствия» (эндорфинов) и тестостерона и, самое главное, приводят к снижению инсулинорезистентности и гиперинсулинемии.
Следует помнить, что физические нагрузки снижают сахар крови, если исходный уровень гликемии меньше 14 ммоль/л. При уровне глюкозы крови выше 14 ммоль/л физические упражнения противопоказаны, так как они вызывают не снижение, а повышение сахара крови и усиливают кетогенез. Также физические нагрузки противопоказаны при уровне гликемии ниже 5,0 ммоль/л. Поэтому перед, во время и после занятий необходимо контролировать уровень сахара крови, а при наличии сопутствующих сердечно–сосудистых заболеваний еще и артериальное давление (АД) и частоту сердечных сокращений (ЧСС) [1].
Медикаментозное управление
сахарным диабетом 2 типа
В Согласованном Постановлении Американской Диабетической Ассоциации и Европейской Ассоциации по изучению диабета было подчеркнуто, что в «общем» гликированный гемоглобин, равный 7%, является той точкой отсчета, на основании которой принимаются те или иные решения. Однако если говорить не об общих, а об индивидуальных целях, то в этом случае гликозилированный гемоглобин должен быть максимально близким к 6%. Таким образом, Согласованное Постановление указало, что HbA1c≥7%, должен рассматриваться как указание к действиям, направленным на изменение терапии.
В этой связи было отмечено, что положительный эффект программы изменения образа жизни, в первую очередь направленной на снижение веса и повышение физической активности может отмечаться достаточно быстро, еще до того, как будет зафиксировано существенное снижение массы тела. Однако ограниченный долгосрочный эффект применительно к снижению уровня гликемии на длительной основе, диктует необходимость назначения медикаментозной терапии у большинства пациентов. Было также подчеркнуто, что выбор целей лечения и медикаментов, которые необходимо использовать для их достижения, должны быть индивидуальны для каждого пациента, балансируя между потенциальным снижением гликированного гемоглобина и долгосрочным положительным влиянием на риск развития осложнений с побочными эффектами, переносимостью препарата и стоимостью лечения.
По мнению экспертов, принимавших участие в разработке Согласованного Постановления, в связи с тем, что изменения образа жизни не позволяют удерживать метаболический контроль в течение длительного времени, на первом этапе одномоментно должен назначаться метформин, практически на этапе установления диагноза. По их мнению, метформин рекомендуется на начальных этапах фармакологического лечения, в случае отсутствия специальных противопоказаний, в связи с его влиянием на уровень гликемии, отсутствия прибавки веса и/или гипогликемии, обычно при низком уровне побочных эффектов, хорошей переносимостью и относительно низкой стоимостью (схема 1) [5].
Бигуаниды
Следует отметить, что в лечении СД 2 типа бигуаниды начали применяться более 50 лет назад. Однако, в связи с частыми случаями возникновения лактат–ацидоза при приеме фенформина и буформина, производные гуанидина практически были исключены из терапии больных диабетом. Известно, что частота развития данного осложнения у разных препаратов неодинакова. Единственным препаратом, разрешенным к применению во многих странах, является метформин.
Сахароснижающее действие метформина обусловлено несколькими механизмами действия, не связанными с секрецией инсулина β–клетками. Во–первых, метформин в присутствии инсулина подавляет продукцию глюкозы печенью за счет повышения чувствительности гепатоцитов к инсулину, снижения глюконеогенеза, активизации обмена лактата, повышения синтеза гликогена и снижения гликогенолиза. Во–вторых, уменьшает инсулинорезистентность на уровне периферических тканей (жировой и мышечной) и печени за счет усиления и потенцирования действия инсулина, повышения сродства рецепторов к инсулину, восстановления нарушенных пострецепторных звеньев передачи сигнала, увеличения числа рецепторов к инсулину в клетках мишенях. В–третьих, метформин повышает утилизацию глюкозы в результате анаэробного гликолиза. В–четвертых, метформин несколько замедляет абсорбцию глюкозы в кишечнике, что в свою очередь приводит к сглаживанию постпрандиальных пиков гликемии. Возможно, это объясняется уменьшением скорости опорожнения желудка и моторики тонкой кишки. В–пятых, при приеме метформина происходит увеличение анаэробной утилизации глюкозы в кишечнике. Таким образом, с учетом перечисленных основных механизмов действия данного препарата правильнее говорить не об истинно гипогликемизирующем (сахароснижающем), а о антигипергликемическом, препятствующем повышению сахара крови, влиянии.
В экспериментальных и клинических исследованиях было показано, что метформин оказывает благоприятное действие на липидный спектр и на свертывающую систему крови. Он снижает концентрацию триглицеридов в плазме в среднем на 10–20%. Достоверное снижение концентрации общего холестерина и холестерина ЛПНП, вероятно, происходит благодаря уменьшению их биосинтеза в кишечнике и печени. Метформин уменьшает концентрации хиломикронов и остатков хиломикронов после еды и несколько повышает концентрации холестерина ЛПВП [6].
Препарат усиливает процессы фибринолиза, вследствие чего уменьшается риск тромбообразования и сосудистых осложнений диабета.
Помимо этого, метформин обладает слабым анорексигенным действием.
Исследование BIGRO (BIGyanides and Prevention of the Risk of Obesity) продемонстрировало, что применение метформина у 324 больных с абдоминальным ожиреним сопровождалось более выраженным по сравнению с плацебо снижением массы тела, инсулина плазмы, общего холестерина и показателей фибринолиза.
В целом, у большинства пациентов переносимость препарата хорошая. Среди побочных эффектов действия метформина следует отметить диарею и другие явления со стороны желудочно–кишечного тракта (металлический привкус во рту, анорексия, тошнота, рвота), которые в начале терапии наблюдаются почти у 20% больных, а затем самостоятельно проходят в течение нескольких дней. По всей видимости, эти расстройства связаны с влиянием метформина на замедление всасывания глюкозы в тонком кишечнике. Накапливаясь в ЖКТ, углеводы вызывают процессы брожения, метеоризм, что может создавать некоторые неудобства для пациента. Предотвращение или уменьшение отрицательного влияния препарата на ЖКТ обеспечивается назначением минимальных доз препарата с постепенной титрацией с интервалом в несколько дней.
Было рекомендовано начинать терапию метформином с низких доз – 500 мг, принимаемых 1 или 2 раза в сутки вместе с приемом пищи (завтрак и/или ужин). Через 5–7 дней, если не отмечены побочные эффекты со стороны желудочно–кишечного тракта, доза метформина может быть увеличена до 850 мг или 1000 мг после завтрака и после ужина. Если в ответ на увеличение дозы развиваются побочные эффекты, то доза снижается до первоначальной, с последующими попытками увеличить дозу позднее.
Было отмечено, что максимально эффективная доза метформина обычно составляет 850 мг два раза в сутки, с умеренно более высокой эффективностью при повышении дозы до 3000 мг. Однако побочные эффекты могут ограничивать использование более высоких доз (табл. 5).
В целом, отдавая должное внимание представленному Согласованному Постановлению, необходимо отметить, что несмотря на наличие приверженцев метформина и в нашей стране, и за рубежом, существует и другая точка зрения, свидетельствующая о необходимости учитывать, что дефекты секреции инсулина играют важную роль в развитии и прогрессировании сахарного диабета 2 типа, а, следовательно, роль других препаратов для лечения сахарного диабета 2 типа должна быть оценена должным образом.
Препараты сульфонилмочевины
Основной механизм действия препаратов сульфонилмочевины (СМ) заключается в стимуляции секреции инсулина. Препараты СМ воздействуют на β–клетки поджелудочной железы, в частности, связываясь и закрывая К–АТФ–зависимые каналы клеточной мембраны. В результате этого происходит деполяризация клеточной мембраны, открытие Са2+ каналов, приток Са2+ и экзоцитоз инсулина из гранул.
Важно отметить, что АТФ–зависимые К+–каналы находятся не только в поджелудочной железе, но и в миокарде, гладкой мускулатуре, нейронах и клетках эпителия. Поэтому, чрезвычайно важной характеристикой для препаратов СМ является специфичность связывания с рецепторами, расположенными именно на поверхности β–клеток поджелудочной железы. Экстрапанкреатические эффекты препаратов СМ убедительно не доказаны, скорее всего, они связаны с уменьшением глюкозотоксичности благодаря стимуляции инсулина.
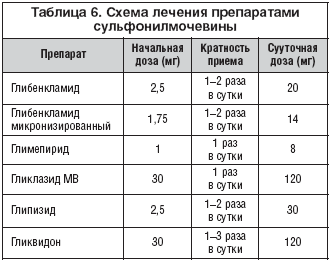
Лечение препаратами СМ, как правило, начинают с максимально низких доз, при необходимости постепенно увеличивая один раз в 5–7 дней до получения желаемого уровня гликемии. Пациентам с выраженной глюкозотоксичностью лечение можно сразу начинать с максимальной дозы, в дальнейшем, при необходимости, снижая ее по мере уменьшения уровня глюкозы крови (табл. 6).
К побочным эффектам препаратов СМ относятся гипогликемия, прибавка массы тела, кожная сыпь, зуд, желудочно–кишечные расстройства, нарушения состава крови, гипонатриемия, гепатотоксичность.
Тиазолидиндионы (глитазоны)
Препараты этой группы принадлежат к новому классу пероральных сахароснижающих агентов, действующих на уровне рецепторов, активируемых пролиферацией пероксисом (PPAR). Эти рецепторы находятся в основном в ядрах клеток жировой и мышечной ткани. PPAR–γ активация повышает чувствительность к инсулину через увеличение экспрессии многочисленных генов, кодирующих протеины, отвечающие за метаболизм глюкозы и свободных жирных кислот (СЖК). В результате чего улучшается чувствительность к инсулину на уровне печени, мышечной и жировой ткани.
Тиазолидиндионы снижают инсулинорезистентность за счет увеличения количества транспортеров глюкозы (ГЛЮТ–1, ГЛЮТ–4) и улучшения условий утилизации глюкозы тканями, снижения уровня СЖК и триглицеридов в крови, усиление инсулинового пептида, подавления продукции глюкозы печенью, снижения фактора некроза опухоли и ремоделирования жировой ткани.
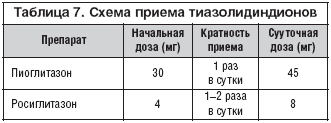
В России зарегистрированы и разрешены к клиническому применению 2 препарата из группы глитазонов: росиглитазон и пиоглитазон (табл. 7).
Тиазолидиндионы противопоказаны пациентам с сахарным диабетом 2 типа и сердечной недостаточностью III–IV класса по NYHA, при повышении печеночных трансаминаз › 3 раза выше верхней границы нормы, при беременности и лактации.
Результаты международных исследований показывают, что глитазоны эффективны для лечения сахарного диабета 2 типа. Применение росиглитазона в дозе 4 и 8 мг в сутки сопровождалось статистически достоверным снижением как уровня гликемии натощак на 0,9–2,1 ммоль/л и на 2–3 ммоль/л соответственно, так и постпрандиально, гликированный гемоглобин уменьшался на 0,3% и 0,6–0,7% соответственно [7]. Помимо этого, было продемонстрировано, что при лечении тиазолидиндионами случаи сердечной недостаточности встречаются с той же частотой, что и в группе плацебо (‹1%), в комбинации с инсулинотерапией – 1–3%, тогда как при проведении только терапии инсулином – 1% [8].
Прандиальные регуляторы (глиниды)
Прандиальные регуляторы – короткодействующие препараты, реализующие свои сахароснижающие свойства путем острой стимуляции секреции инсулина, что позволяет эффективно контролировать уровень гликемии после еды.
Механизм действия препаратов данной группы заключается в закрытии АТФ– чувствительных К+ каналов в клетках поджелудочной железы, что способствует деполяризации и открытию Са2+ каналов, в связи с чем увеличивается поступление кальция в β–клетки, что, в свою очередь, приводит к секреции инсулина.
Важно отметить, что действие глинидов на АТФ–чувствительные К+ каналы в β–клетке сопоставимо по силе действия с препаратами СМ, но реализуют данный эффект эти две группы препаратов через различные места связывания на поверхности β–клетки.
В нашей стране зарегистрированы два препарата этой группы: репаглинид и натеглинид (табл. 8).
Ингибиторы α–глюкозидазы
К этой группе препаратов относятся средства, которые конкурируют с пищевыми углеводами за связывающие центры ферментов желудочно–кишечного тракта, участвующих в расщеплении и всасывании углеводов, то есть являются конкурентными ингибиторами.
В нашей стране зарегистрирован только один препарат из этой группы – акарбоза.
Под действием акарбозы количество поглощаемых углеводов не уменьшается, но их всасывание значительно замедляется, тем самым надежно предотвращая резкое повышение сахара крови после еды. При этом сам препарат практически не расщепляется и не всасывается в кровь.
Акарбоза не стимулирует секрецию инсулина из β–клеток поджелудочной железы, поэтому не приводит к гиперинсулинемии, не вызывает гипогликемии. Замедление всасывания глюкозы в кровь под влиянием данного препарата облегчает функционирование поджелудочной железы и предохраняет ее от перенапряжения и истощения. Доказано, что акарбоза уменьшает инсулинорезистентность. При длительном применении приводит к выравниванию суточной гликемической кривой, снижению среднесуточного уровня гликемии, уменьшению уровня гликемии натощак, а также к снижению и нормализации уровня гликированного гемоглобина, что способствует профилактике поздних осложнений сахарного диабета [1]. Лечение акарбозой начинают с 50 мг во время ужина, постепенно увеличивая дозу до 300 мг в сутки (по 100 мг 3 раза в день).
И, наконец, следует отметить результаты применения акарбозы с целью профилактики сахарного диабета 2 типа – Stop NIDDM. В рамках этого исследования было продемонстрировано, что применение акарбозы у пациентов с нарушенной толерантностью к глюкозе позволило снизить риск развития сахарного диабета 2 типа на 37% [9].
Инкретиномиметики (агонисты рецепторов глюкагоно–подобного полипептида–1)
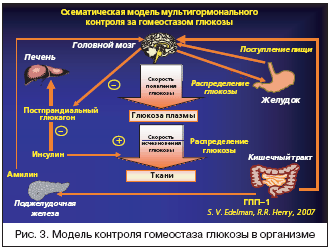
Первый инкретиномиметик, утвержденный US FDA для лечения больных сахарным диабетом 2 типа, является эксенатид (BYETTA). Механизм действия этого препарата тесно связан с основными биологическими эффектами гормонов желудочно–кишечного тракта – инкретинами. Известно, что прием пищи стимулирует образование многих гормонов желудочно–кишечного тракта, вовлеченных в регуляцию секреции желудочного сока, панкреатических ферментов, вызывает сокращение желчного пузыря и обеспечивает всасывание нутриентов (рис. 3).
Наиболее популярным и наиболее изученным в настоящее время является глюкагоно–подобный полипептид–1 (ГПП–1). ГПП–1 продуцируется энтеро–эндокринными L–клетками тонкого кишечника, и регуляция его секреции из эндокринных клеток ЖКТ осуществляется с помощью нескольких внутриклеточных сигналов, включая протеин киназу А, протеин киназу С и кальций. Многочисленные экспериментальные работы продемонстрировали, что секреция ГПП–1 контролируется нутриентами, а также нервными и эндокринными сигналами. В исследованиях Kieffer T.Y., 1999, Drucker D.J., 1998, Massimo S.P., 1998, было показано, что ГПП–1 секретируется в ответ на прием смешанной пищи и таких отдельных составляющих, как глюкоза, жирные кислоты и пищевые волокна. Так, пероральный прием глюкозы у человека приводил к двухфазному увеличению ГПП–1 в плазме, тогда как внутривенные инфузии глюкозы име-ли минимальный эффект [Hermann C., 1995]. Период полужизни циркулирующего, биологически активного ГПП–1 меньше, чем 2 минуты. Такой короткий период полужизни ГПП–1 в плазме обусловлен протеазной активностью фермента дипептидилпептидаза IV (ДПП–IV). Учитывая роль желудочно–кишечных гормонов в регуляции углеводного обмена предложены два новых класса препаратов: инкретиномиметики и ингибиторы ДПП–IV.
Под действием эксенатида происходит глюкозозависимое усиление секреции инсулина, восстановление первой фазы секреции инсулина, подавление секреции глюкагона и СЖК, замедление опорожнения желудка и уменьшение потребления пищи [10–12].
В различных международных исследованиях было продемонстрировано, что эффекты эксенатида независимы от длительности и степени тяжести сахарного диабета 2 типа [13,14].
Стартовая доза эксенатида 5 мкг два раза в сутки в течение 60 минут перед завтраком и перед ужином. Через 1 месяц от начала терапии дозу можно увеличить до 10 мкг два раза в сутки.
Основным побочным явлением является тошнота легкой или умеренной степени тяжести, проходящая через 1–2 недели.
Таким образом, этот принципиально новый класс препаратов показан для лечения пациентов с сахарным диабетом 2 типа как дополнительная терапия к метформину, производным сульфонилмочевины или их комбинации для улучшения гликемического контроля.
Ингибитор дипептидилпептидазы–IV
В прошлом году на мировом фармацевтическом рынке появился новый класс пероральных препаратов для лечения сахарного диабета 2 типа – ингибитор ДПП–IV. Первым и единственным представителем данного класса, рекомендованным FDA, является ситаглиптин. Механизм действие этого препарата, также как и действие эксенатида, тесно связан с основными биологическими эффектами гормонов желудочно–кишечного тракта. Ситаглиптин является мощным, полностью обратимым ингибитором фермента ДПП–4, тем самым приводящим к повышению уровня активных форм инкретинов. Действие ситаглиптина состоит в усилении глюкозозависимого инсулинового ответа и одновременное подавление глюкозозависимой секреции глюкагона на фоне повышения уровня глюкозы крови. По результатам проведенных многочисленных международных исследований ситаглиптина получены следующие данные:
• значительное и стабильное снижение уровней глюкозы плазмы натощак;
• значительное снижение колебаний уровней глюкозы плазмы после приема пищи;
• значительное снижение уровня гликированного гемоглобина;
• улучшение функции b–клеток.
Частота гипогликемии в проведенных исследованиях была низкой и равной той, которая наблюдалась при приеме плацебо. Ситаглиптин не влияет на массу тела, что также важно при лечении больных сахарным диабетом 2 типа и ожирением. Данный препарат имеет большую продолжительность действия, поэтому принимается 1 раз в сутки.
Инсулинотерапия
Несмотря на большой выбор на фармацевтическом рынке различных групп пероральных сахароснижающих препаратов, которые модулируют различные патофизиологические аспекты сахарного диабета 2 типа, редко удается добиться и поддерживать длительное время целевые значения гликемии. Исследование, проводившееся в рамках UKPDS, подтвердило, что ранее присоединение инсулинотерапии к терапии пероральными сахароснижающими препаратами может безопасно поддерживать HbA1c близко к 7% в первые 6 лет после установления диагноза. Таким образом, переход на инсулинотерапию при сахарном диабете 2 типа с целью компенсации функции β–клеток является логичным терапевтическим подходом для достижения оптимального контроля гликемии [15].
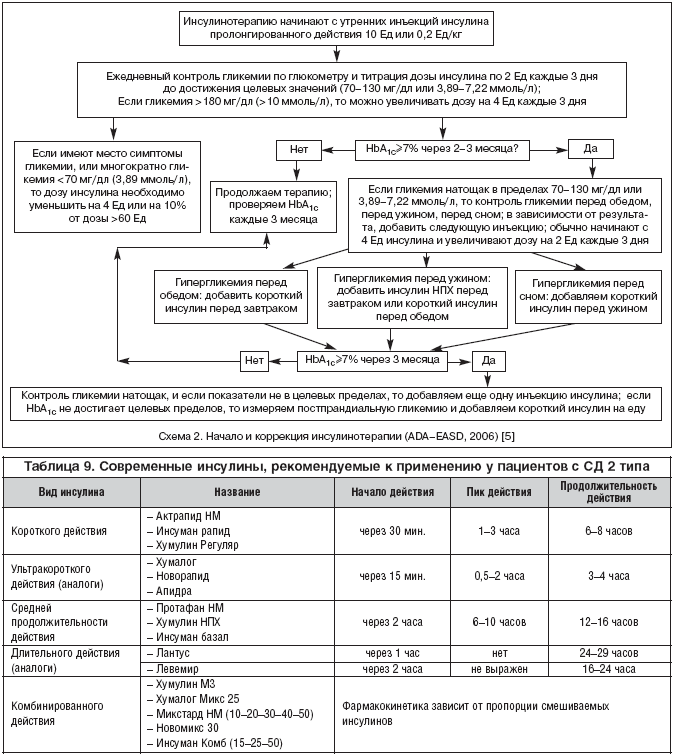
Эксперты, принимавшие участие в Согласованном Постановлении Американской Диабетической Ассоциации и Европейской Ассоциации по изучению диабета, предлагают следующую схему инициации инсулинотерапии у больных сахарным диабетом 2 типа (схема 2) [5].
Таким образом, инсулинотерапия показана при неэффективности диеты и максимальных доз сахароснижающих препаратов (HbA1c›>7,5%, гликемия натощак >8,0 ммоль/л при ИМТ<25 кг/м2), при наличии кетоацидоза, временный перевод на инсулинотерапию показан при оперативном вмешательстве.
Современные виды инсулинов представлены в таблице 9 [3].
Комбинированная терапия
Многим пациентам с сахарным диабетом 2 типа для достижения и поддержания в течение длительного времени целевых значений гликемии монотерапии обычно бывает недостаточно.
Исследование UKPDS продемонстрировало прогрессивное течение СД 2 типа. Известно, что функция β–клеток ухудшается со скоростью примерно 5% в год от момента установления диагноза. Этим объясняется снижение эффективности монотерапии, выявленным при оценке количества пациентов, имевших уровень гликированного гемоглобина менее 7% через 3,6 и 9 лет от начала наблюдения. Таким образом, с целью сохранения контроля гликемии и предупреждения развития осложнений диабета необходимо постоянное усиление сахароснижающей терапии [16]. Поэтому, применение комбинированной терапии на ранних и последующих этапах заболевания считается вполне оправданным. Следует отметить, наиболее предпочтительными являются комбинации пероральных сахароснижающих препаратов, воздействующих на оба патофизиологических дефекта сахарного диабета 2 типа (например, метформин в сочетании с сульфонилмочевиной, сульфонилмочевина в комбинации с эксенатидом). Наиболее эффективной комбинацией является инсулин в сочетании с метформином. Важно отметить, что комбинированная терапия инсулина и тиазолидиндионов в настоящее время в странах Евросоюза не утверждена.
Немаловажную роль при лечении пациентов играет степень выполнения рекомендаций, предписанных врачом (комплаентность). Очевидно, что чем больше количество препаратов, тем комплаентность ниже. В связи с этим фармацевтическими компаниями разработаны фиксированные комбинированные препараты. Такая терапия обеспечивает максимальную эффективность в достижении почти нормального гликемического контроля: имеется возможность снизить до минимума побочные действия компонентов комбинации за счет низкой дозировки. Все это приводит к улучшению качества жизни больных и повышает приверженность к лечению.
Заключение
В заключение еще раз хотелось бы отметить важность достижения и поддержания в течение длительного времени целевых значений гликемии. Большинству пациентов на первом этапе одномоментно с рекомендациями по питанию и режиму физических нагрузок должен назначаться метформин, практически на этапе установления диагноза. При невозможности достижения или поддержания «околонормальных» значений гликемии с помощью одной группы препаратов показано назначение комбинированной терапии. С учетом результатов международных исследований рекомендуется более ранее назначение инсулинотерапии пациентам, не достигшим целевых значений гликемии с помощью пероральных сахароснижающих препаратов.
![Таблица 2. Цели терапии углеводного обмена [European Diabetes Policy Group, 1998–1999]](http://www.rmj.ru/data/articles/Image/t16/n4/170-2.gif)

![Рис. 2. Пирамида физической активности [2]](http://www.rmj.ru/data/articles/Image/t16/n4/170-5.gif)
![Схема 1. Управление гликемией при СД 2 типа (ADA+ EASD) [5]](http://www.rmj.ru/data/articles/Image/t16/n4/170-6.gif)


Литература
1. А.С. Аметов. Сахарный диабет 2 типа. Основы патогенеза и терапии; Москва 2003.
2. А.С. Аметов, Т.Ю.Демидова, Е.В.Доскина, Н.А.Черникова. Алгоритм диагностики и управления сахарным диабетом 2 типа. Клинические рекомендации для практикующих врачей; Москва 2007.
3. И.И.Дедов, М.В.Шестакова. Алгоритмы специализированной медицинской помощи больным сахарным диабетом; Москва 2007.
4. D.M.Nathan et Al. Management of hyperglycaemia in type 2 diabetes mellitus: a consensus algorithm for the initiation and adjustment of therapy (ADA–EASD). Diabetologia, 2008, 51: 8–11.
5. D.M.Nathan et Al. Management of hyperglycaemia in type 2 diabetes mellitus: a consensus algorithm for the initiation and adjustment of therapy (ADA–EASD). Diabetologia, 2006, 49: 1711–1721.
6. И.И.Дедов, М.В.Шестакова. Сахарный диабет; Москва 2003.
7. Miyazaki Y., Glass L., Triplitt C. et Al. Effect of rosiglitazone on glucose and non–esterified fatty acid metabolism in type II diabetic patients. Diabetologia, 2001, 44: 2210–2219.
8. Nesto R.W., Thiazolidinedione use, fluid retention and congestive heart failure: a consensus statement from the American heart association and American diabetes association. Diabetes care, 2004, 27: 256–263.
9. Polonsky K. Alternations in immunoreactive proinsulin and insulin clearance inducted by weight loss in NIDDM. Diabetes, 1994, 43: 871–877.
10. DAlessio D.A, Vahl T.P. Glucagon–like peptide 1: evolution of an incretin into a treatment for diabetes. Am J Physiol Endocrinol Metab. 2004, 286: E882–E90.
11. Drucker DJ. Biological action and therapeutic potenctial of the glucagons–like peptides. Gastroenterology, 2002, 122: 531–544.
12. Egan J.M., Meneilly G.S., Elahi D. Effects of 1–mo bolus subcutaneous administration exentid–4 in type 2 diabetes. Am J Physiol Endocrinol Metab. 2003, 284: E1072–E1079.
13. Drucker DJ. Enhancing incretin action for the treatment of type 2 diabetes. Diabetes Care, 2003, 26: 2929–2940.
14. Heine R.J., Van Gaal L.F., Johns D. et Al. Exenatide versus insulin glargine in patients with suboptimalli controlled type 2 diabetes. Ann Intern Med, 2005, 143(8): 559–569.
15. Wright A. et Al. Sulfonilurea inadequacy: efficacy of addition of insulin over 6 years in patients with type 2 diabetes mellitus in U.K. prospective Diabetes Study (UKPDS 57). Diabetes Care, 2002, 25: 330–336.
16. UK Prospective Diabetes Study Group: UK Prospective Diabetes Study 16: overview of 6 years therapy of type II diabetes: a progressive disease. Diabetes, 1995, 44: 1249–1258.
rmj.ru
| 









![Таблица 2. Цели терапии углеводного обмена [European Diabetes Policy Group, 1998–1999]](http://www.rmj.ru/data/articles/Image/t16/n4/170-2.gif)


![Рис. 2. Пирамида физической активности [2]](http://www.rmj.ru/data/articles/Image/t16/n4/170-5.gif)
![Схема 1. Управление гликемией при СД 2 типа (ADA+ EASD) [5]](http://www.rmj.ru/data/articles/Image/t16/n4/170-6.gif)







 Новости
Новости 