Возросший интерес к проблеме метаболического синдрома у женщин в период
менопаузы обусловлен большим количеством фактических данных, свидетельствующих
о существенном влиянии его на развитие атеросклероза, а также тем, что за
последнее время заметно увеличилась его распространенность. Термин
«метаболический синдром» используют в том случае, когда у одного больного
имеется несколько факторов риска, таких, как артериальная гипертония (АГ),
инсулиновая резистентность, дислипидемия, абдоминальное ожирение, оказывающих
синергидное действие на процессы атерогенеза.
Распространенность сердечно-сосудистых заболеваний, в том числе АГ, у
мужчин в средних возрастных группах превышает таковую у женщин. Однако
наступление менопаузы сопровождается заметным ростом кардиоваскулярной
заболеваемости у женщин, что происходит на фоне неблагоприятных метаболических
изменений, выражающихся прежде всего в нарушениях липидного и углеводного
обмена. Начало менопаузы у женщин сопровождается снижением уровня эстрогенов и
ростом уровня андрогенов, что способствует увеличению массы тела. За последние
несколько десятилетий во всех странах наблюдается увеличение числа лиц,
страдающих ожирением, что сопровождается ростом распространенности
инсулинорезистентности и сахарного диабета (СД) 2 типа.
В ряде исследований было продемонстрировано, что резистентность тканей к
инсулину имеет важное значение в патогенезе АГ, возникающей у больных с
метаболическим синдромом. Длительная гиперинсулинемия, возникающая у больных с
инсулинорезистентностью, вызывает парадоксальную вазоконстрикцию, стимуляцию
симпатической нервной системы, увеличение объема циркулирующей крови за счет
увеличения реабсорбции ионов натрия и воды в дистальных канальцах нефронов.
Кроме того, инсулин является фактором, стимулирующим клеточный рост, поэтому
гиперинсулинемия способствует пролиферации сосудистых гладкомышечных клеток и
увеличению сосудистого сопротивления. Инсулин оказывает влияние на механизмы
трансмембранного ионного транспорта, и увеличение его концентрации приводит к
повышению внутриклеточной концентрации ионов натрия и калия, с чем связывается
повышение чувствительности гладкомышечных клеток артериол к прессорному
влиянию катехоламинов и ангиотензина II [1–4].
Сочетание АГ и инсулиновой резистентности у одного больного повышает
требования к медикаментозной терапии, которая в этих условиях, влияя на один
из компонентов метаболического синдрома, не должна усиливать действие другого.
Основные требования к препарату выбора для лечения АГ у женщин с
метаболическим синдромом в постменопаузе заключаются в том, что он должен
обладать выраженным антигипертензивным эффектом, способностью улучшать
метаболизм глюкозы, не ухудшать инсулиновую резистентность тканей,
ограничивать влияние на сердечно-сосудистую систему нейрогуморальных факторов,
снижать активность симпатической нервной системы, уменьшать задержку натрия и
воды, не ухудшать симптомы менопаузы.
В качестве антигипертензивных средств новой генерации, обладающих
указанными свойствами, рассматриваются агонисты I1-имидазолиновых
рецепторов. Как было продемонстрировано в ходе плацебоконтролируемого
исследования, проведенного N. De Luca, R. Izzo, D. Fontana и соавторами (2000)
и включавшего 72 пациента с АГ и избыточной массой тела, лечение агонистом I1-имидазолиновых
рецепторов моксонидином в течение 8 нед вызывало достоверное улучшение
чувствительности периферических тканей к инсулину [16].
Целью исследования стали сравнительная характеристика антигипертензивной
активности и влияния на показатели углеводного обмена агониста I1-имидазолиновых
рецепторов моксонидина (физиотенза) и β-адреноблокатора метопролола у женщин с
метаболическим синдромом в постменопаузальном периоде.
В исследование были включены 40 женщин, в возрасте от 48 до 58 лет (средний
возраст 55 ± 5,4 года), с увеличением массы тела (индекс массы тела (ИМТ) 32 ±
3 кг/м2), наличием АГ I–II степени (при измерении аускультативным
методом — систолическое АД (САД) составило 153,9±10 мм рт. ст.; диастолическое
АД (ДАД) — 95,7 ± 5 мм рт. ст.; по данным суточного мониторирования АД (СМАД)
среднесуточное САД составило 37±12,7 мм рт. ст., среднесуточное ДАД — 82,6 ± 9
мм рт. ст.), уровнем глюкозы натощак — 6,1 ± 0,9 ммоль/л. У всех женщин
наступила естественная менопауза и никто из них не получал
гормонозаместительную терапию. Больные были рандомизированы в группы лечения
моксонидином (физиотенз, Solvey Pharma) 0,2–0,4 мг/сут либо метопрололом
100–150 мг/сут. В первую группу вошла 21 больная, во вторую группу — 19
больных. В выделенных группах больные статистически достоверно не различались
по таким показателям, как возраст, длительность анамнеза АГ, масса тела.
Началу активного лечения предшествовал 2-недельный контрольный период, на это
время отменялась ранее назначенная антигипертензивная терапия. Включенные в
исследование пациентки получали моксонидин либо метопролол в виде монотерапии;
комбинации указанных препаратов с другими антигипертензивными средствами не
назначались.
Сбор анамнестических данных и клиническое обследование больных с анализом
проявлений менопаузальных симптомов проводились при включении пациенток в
исследование, а также в конце контрольного периода, через 2, 6 и 12 нед
терапии. При 3-м и 4-м визитах при уровне АД 140/90 мм рт. ст. и выше (по
данным казуальных измерений) дозу препаратов увеличивали до 0,4 мг моксонидина
и 150 мг метопролола в сутки.
Клиническое артериальное давление (АДкл.) определяли как среднюю величину
трех измерений АД ртутным сфигмоманометром по методу Короткова, выполненных в
положении обследуемого сидя после 5 мин отдыха в отсутствие терапии или спустя
2–3 ч после приема препарата.
СМАД проводилось с помощью прибора CardioTens-01 (Mediteck, Венгрия).
Средняя продолжительность мониторирования составила 24 ± ± 0,5 ч. В период с
10 до 22 ч АД регистрировалось каждые 15 мин, с 22 до 5 ч — каждые 30 мин, с 5
до 10 ч — каждые 10 мин.
При проведении СМАД оценивались такие параметры, как среднесуточный,
среднедневной, средненочной уровни САД и ДАД, а также показатели нагрузки
давлением (индекс времени и индекс площади гипертонии), вариабельности АД, и
вычислялся суточный индекс. Уровень среднесуточного АД более или равный 130 мм
рт. ст. для САД и более или равный 80 мм рт. ст. для ДАД рассматривался как
повышенный [6, 7].
Велоэргометрическая проба (ВЭМ) проводилась с целью определения характера
изменений АД в условиях динамической физической нагрузки. ВЭМ выполнялась
после мониторирования АД, при отсутствии противопоказаний к проведению
нагрузочной пробы, в утренние часы, после легкого завтрака, в положении лежа с
использованием метода ступенчато-возрастающей нагрузки. Исследование
проводилось исходно через 14 дней после отмены антигипертензивной терапии и на
фоне терапии препаратом, через 3–4 ч после приема его очередной дозы. Пробу
начинали с нагрузки 25 Вт, мощность нагрузки повышали на 25 Вт с интервалом в
3 мин. АД и ЧСС регистрировались исходно и с интервалом в 1 мин во время
нагрузки и в течение каждой минуты восстановительного периода. Мониторирование
электрокардиограммы в 12 стандартных отведениях проводилось в течение всей
пробы, регистрация — на 3 минуте каждой ступени нагрузки.
Для оценки гипертензивной реакции АД использовали критерии гипертензивной
реакции, которые заключались в повышении АД более 200/100 мм рт. ст. при ВЭМ
на фоне нагрузки 100 Вт и превышение предела 140/90 мм рт. ст. для АД на 5-й
минуте восстановительного периода [8].
Изометрическая проба проводилась следующим образом. С помощью динамометра
определяли максимальную силу в правой руке пациента. Затем в течение 3 мин
пациент сжимал динамометр с силой, составляющей 30 % от максимальной. АД и ЧСС
регистрировалось непосредственно перед пробой исходно и в конце 3-й минуты
сжимания динамометра. ЭКГ регистрировалось в течение 3 мин восстановительного
периода. Оценивались максимальные САД, ДАД, ЧСС, измеренные на высоте нагрузки
(в конце 3-й минуты), а также прирост САД, ДАД, ЧСС — разница максимального
САД, ДАД, ЧСС и исходных значений.
Оценка параметров углеводного обмена и инсулинемии включала в себя
проведение стандартного глюкозотолерантного теста (ГТТ) с параллельным
определением уровня глюкозы и инсулина в сыворотке крови натощак и на 30, 60 и
120-й минутах ГТТ.
Уровень глюкозы крови определялся стандартным глюкозооксидазным методом.
Уровень инсулина в сыворотке крови устанавливали радиоиммунологическим методом
с использованием стандартных наборов реактивов РИО-ИНС-ПГ1251. По результатам
проведенного исследования были рассчитаны интегральные показатели: площадь под
кривой глюкозы (ППКГ) и площадь под кривой инсулина (ППКИ) [10]. Расчеты
производили по методу суммы трапеций с применением следующих формул:
ППКГ = 1/2 х (Г30–Г0) х 30 + Г0 х 30 + 1/2 х (Г30–Г60) х 30 + Г60 х 30
+ 1/2 (Г60–Г120) х 60 + Г120 х 60,
где Г0 — уровень глюкозы в крови натощак; Г30, Г60, Г120 — уровни глюкозы в
крови через 30, 60 и 120 мин после нагрузки глюкозой;
ППКИ = 1/2 х (И30 — И0) х 30 + И0 х 30 + 1/2 х (И30 — И60) х 30 + + И60
х 30 + 1/2 (И60–И120) х 60 + И120 х 60,
где И0 — уровень инсулина в сыворотке крови натощак; И30, И60, И120 —
уровни инсулина в сыворотке крови через 30, 60 и 120 мин после нагрузки
глюкозой.
Статистический анализ проводили с помощью пакета программ Exсel 7.0 и
Statgraphics 2.1 с использованием рекомендованных критериев. Различия считали
достоверными при p < 0,05. Результаты представлены в виде M ± SD.
По данным клинического измерения АД, терапия моксонидином и метопрололом
характеризовалась положительным антигипертензивным эффектом (табл.). При этом
доля пациентов, у которых удалось достигнуть снижения АД до уровня менее
140/90 мм рт. ст. в группах моксонидина и метопролола существенно не
различалась и составила 71 и 80% соответственно. Межгрупповые различия по
изучаемым показателям как до лечения, так и спустя 3-месячный период терапии
были статистически недостоверны. Существенной динамики ЧСС в группе лиц,
получающих моксонидин, отмечено не было, тогда как на фоне приема
β-адреноблокатора данный показатель достоверно снизился.
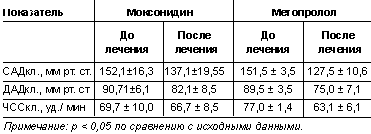
Таблица. Динамика измерений АД и ЧСС на фоне терапии
моксонидином и метопрололом
Полученные результаты свидетельствуют о том, что оба препарата оказывают
сопоставимый антигипертензивный эффект, особенность которого заключалась в
преимущественном влиянии на уровень систолического АД в дневной период суток.
В настоящем исследовании не было отмечено достоверного влияния изучаемых
препаратов на такие показатели, как вариабельность АД, суточный индекс, индекс
гипертонии, индекс площади гипертонии, а также двойное произведение, что мы
объясняем отсутствием выраженных изменений данных параметров в обеих группах
исходно.
С целью оценки влияния препаратов на функционально-адаптационные
возможности кровообращения гемодинамические показатели регистрировались в ходе
проведения ВЭП. При этом были установлены значительные преимущества
β-адреноблокатора в отношении подавления гипертензивной реакции, возникающей в
условиях данного варианта стресс-тестирования. Подобный вывод можно было
сделать при анализе гемодинамических показателей, зарегистрированных уже при
мощности нагрузки 50 Вт.
С другой стороны, результаты пробы с изометрической нагрузкой не позволяли
однозначно судить о преимуществах метопролола и отражали сопоставимый эффект
сравниваемых препаратов в отношении подавления гипертензивной реакции.
В ходе исследования не было выявлено статистически значимого изменения
уровня гликемии на фоне приема как моксонидина, так и метопролола, что
отражает представленная на рисунке 1 динамика интегрального показателя ППКГ.
Тем не менее в группе лечения моксонидином отмечалась тенденция к уменьшению
(7,6 %), а в группе метопролола — повышение (3,6 %) уровня глюкозы в
сыворотке.
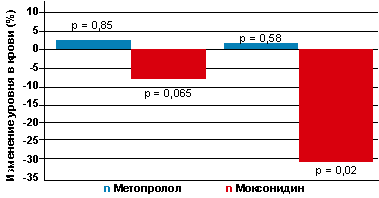
Рисунок 1. Динамика измений уровня глюкозы и инсулина в
крови (%) до лечения и на фоне приема метопролола и моксонидина через 12
недель терапии
Сравнительный анализ влияния препаратов на гиперинсулинемию — критерий
инсулинорезистентности — свидетельствовал о статистически достоверном снижении
уровня инсулина в плазме только в группе больных, получавших моксонидин (рис.
2). Это отражает важную сторону эффекта данного препарата, имеющую значение в
контексте патогенетической терапии артериальной гипертонии у лиц с
метаболическим синдромом.
Применение моксонидина и метопролола не сопровождалось развитием серьезных
побочных эффектов, требовавших отмены препарата; переносимость препаратов в
целом оценена как хорошая. У 3 больных на фоне приема моксонидина, отмечалось
появление сухости во рту, которая возникла в первые дни лечения и исчезла при
продолжении терапии. У 6 пациенток, получавших метопролол, наблюдались явления
мышечной слабости, нарушения сна, неприятные ощущения в нижних конечностях.
Принимая во внимание значение СД 2 типа для развития кардиоваскулярных
осложнений, разработка мероприятий, направленных на первичную профилактику
данного заболевания, является актуальной и чрезвычайно важной задачей. В
значительной мере успех ее решения при лечении больных с метаболическим
синдромом определяется эффектами антигипертензивных препаратов, и в частности
их способностью оказывать влияние на процессы углеводного и липидного обмена.
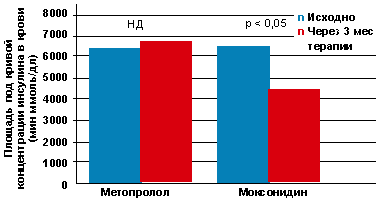
Рисунок 2. Сравнительная динамика инсулинемии на фоне
терапии метопрололом и моксонидином, по результатам расчета ППКИ
С этих позиций включение в терапию лиц, страдающих АГ, препаратов,
обладающих не только выраженной антигипертензивной активностью, но и
положительно влияющих на метаболический профиль, соответствует цели лечения
больных АГ [9].
Результаты настоящего исследования свидетельствуют о высокой
антигипертензивной эффективности как агониста I1-имидазолиновых
рецепторов моксонидина (физиотенза), так и β-адреноблокатора метопролола у
женщин с метаболическим синдромом в периоде постменопаузы. Данный контингент
больных можно рассматривать как категорию лиц, имеющих высокий риск развития
СД 2 типа и его кардиоваскулярных осложнений. Поэтому представляется важным
тот факт, что у большей части больных использование этих препаратов в режиме
монотерапии позволяет достигнуть целевых значений АД.
Результаты СМАД подтверждают вывод о том, что антигипертензивная активность
агониста I1-имидазолиновых рецепторов моксонидина (физиотенза) и
β-адреноблокатора метопролола сопоставимы. В ходе некоторых исследований
удалось [10, 11] продемонстрировать влияние β-адреноблокаторов и агонистов I1-имидазолиновых
рецепторов на среднедневной уровень диастолического АД. Отсутствие подобной
тенденции в нашем исследовании можно объяснить тем, что среди обследованных
больных были лица с исходно невысоким уровнем диастолического АД. О
положительном антигипертензивном эффекте исследованных препаратов
свидетельствуют также результаты нагрузочных проб (ВЭМ и пробы с
изометрической нагрузкой).
Тот факт, что большая выраженность антигипертензивного эффекта препаратов
совпадала с периодом максимальной активности нейрогуморальных систем, в
значительной степени определяет их клиническое значение. С другой стороны,
отсутствие чрезмерного снижения АД в периоды преимущественно вагусной
активности, позволяет использовать агонисты I1-имидазолиновых
рецепторов, наряду с β-адреноблокаторами в тех ситуациях, когда выраженный
гипотензивный эффект нежелателен (в частности, суточный профиль АД имеет вид
over-dipper).
Особенностью гемодинамической реакции в ответ на применение агониста I1-имидазолиновых
рецепторов моксонидина в дозах 0,2–0,4 мг/сут в сравнении с использованием
β-адреноблокатора метопролола следует считать отсутствие статистически
значимого урежения ЧСС. Отсутствие отрицательного хронотропного эффекта при
использовании агониста I1-имидазолиновых рецепторов при назначении
его в средних терапевтических дозах позволило ряду авторов сделать вывод о
большем значении снижения периферического сосудистого сопротивления в
механизме антигипертензивного действия моксонидина [12].
Важной стороной клинической эффективности агонистов I1-имидазолиновых
рецепторов является благоприятное влияние на показатели углеводного обмена,
которое уже было продемонстрировано в целом ряде исследований [13]. Однако в
краткосрочных исследованиях достоверного влияния препаратов данной группы на
метаболизм глюкозы выявить, как правило, не удается [14]. В нашем исследовании
изменения гликемии на фоне лечения агонистом I1-имидазолиновых
рецепторов и β-адреноблокатором были не достоверными, носили характер
тенденций, хотя и противоположных. Поэтому особое значение имело изучение
характера влияния данных групп препаратов на гиперинсулинемию, как основной
лабораторный маркер инсулинорезистентности.
При этом нами отмечено статистически достоверное снижение степени
гиперинсулинемии на фоне приема моксонидина и отсутствие подобного эффекта у
метопролола. Это указывает на уменьшение выраженности инсулинорезистентности
под влиянием терапии агонистом I1-имидазолиновых рецепторов
моксонидином и отражает корригирующее влияние данного препарата в отношении
основного звена патогенеза метаболического синдрома.
Механизм влияния моксонидина на состояние инсулинорезистентности тканей в
настоящее время до конца не изучен. Предполагается, что имеют место как
центральный, так и периферические эффекты препарата, связанные с влиянием на
имидазолиновые рецепторы в поджелудочной железе и других тканях. Кроме того,
моксонидин повышает чувствительность инсулиновых рецепторов, оптимизирует
процессы утилизации глюкозы, улучшает секрецию инсулина [15].
Результаты нашего исследования свидетельствуют также о хорошей
переносимости моксонидина при лечении им в течение нескольких месяцев. Это
особенно важно для оптимизации терапии женщин в климактерическом периоде,
имеющих проявления метаболического синдрома. На основании вышесказанного можно
сделать следующие выводы.
- Агонист I1-имидазолиновых рецепторов моксонидин (физиотенз)
при использовании в качестве монотерапии АГ I–II степени у женщин в период
постменопаузы, имеющих проявления метаболического синдрома, обладает высокой
антигипертензивной эффективностью, сопоставимой с таковой у
β-адреноблокатора метопролола. Это отражает динамика АД при клинических
измерениях, СМАД, а также его регистрация во время нагрузочных проб.
- Моксонидин (физиотенз) при длительном применении характеризуется хорошим
профилем безопасности и низкой частотой развития побочных эффектов.
- Применение моксонидина (физиотенза) в течение 3-месячного периода
сопровождается уменьшением выраженности резистентности тканей к инсулину,
что отражает положительная динамика инсулинемии.
При выборе средств антигипертензивной терапии для женщин с метаболическим
синдромом в период менопаузы необходимо учитывать влияние лекарственных
препаратов на обмен липидов и чувствительность тканей к инсулину. Поэтому
важное место в лечении таких больных должны занимать агонисты I1-имидазолиновых
рецепторов, обладающие выраженным антигипертензивным эффектом и повышающие
чувствительность тканей к инсулину.
Литература
- Kaplan N. M. The deadly quartet: upper-body obesity, glucose intolerance,
hypertriglyceridemia and hypertension //Arch. Intern. Med.1989;149 :
1514–1520.
- Зимин Ю. В. Происхождение, диагностическая концепция и клиническое
значение синдрома инсулинорезистентности или метаболического синдрома Х.
//Кардиология. 1998. № 6. С. 71–81.
- Williams B. Insulin resistance: the shape of things to come //Lancet.
1994; 344 : 521–524.
- Sowers J. R., Standley P. R., Ram J. L. et al. Hyperinsulinemia, insulin
resistance and hyperglycemia: contributing factors in pathogenesis of
hypertension and atherosclerosis // Am. J. Hypertens. 1993; 6 : 260–270.
- Ernsberger P., Damon T. H., Graff L. M. et al. Moxonidine, a centrally
acting anti-hypertensive agent, is a selective ligand for Il-imidazoline
sites. J Pharmacol Exp Ther 1993;264:172–82.
- Gerin W., Rosofsky M., Pieper C., Pickering T.G. A test of
reproducibility of blood pressure and heart rate variability using a
controlled ambulatory procedure. J. Hypertens. 1993, Oct; 11(10):1127–31.
- Staessen J. A., Fagard R. H., Lijnen P. J, Thijs L., Van Hoof R., Amery
A. K. Mean and range of the ambulatory pressure in normotensive subjects
from a meta-analysis of 23 studies. Am. J. Cardiol., 1991, Apr
1;67(8):723–7.
- Аронов Д. М., Лупанов В. . Функциональные пробы в кардиологии. М., 2002.
С. 132–134.
- 2003 European Society of Hypertension — European Society of Cardiology
guidelines for the management of arterial hypertension. Guidelines Committee.
J. Hypertension 2003; 21 (6): 1011–1053.
- Кашерининов Ю. Р., Шаварова Е. К., Шаваров А. А., Конради А. О., Шляхто
Е. В. Динамика показателей углеводного и липидного обмена у больных
гипертонической болезнью на фоне терапии рилменидином в сравнении с
атенололом//Артериальная гипертензия. 2004. Т. 10. №1. С. 28–32.
- Куликов А. Н., Бобров Л. А. Действие некоторых антигипертензивных
средств на суточный профиль артериального давления у больных гипертонической
болезнью//TERRA MEDICA nova. 2003. № 4. С. 3–7.
- Динамика показателей углеводного и липидного обмена у больных
гипертонической болезнью на фоне терапии рилменидином в сравнении с
атенололом//Артериальная гипертензия. 2004. Т. 10. № 1. С. 28–32.
- Friedman J. E., Ishizuka T., Liu S. et al. Anti-hyperglycemic activity
of moxonidine: metabolic and molecular effects in obese spontaneously
hypertensive rat//Blood Pressure, 1998 (Suppl. 3). 32–39.
- Prichard B., Graham B., Owens C. Moxonidine: a new antiadrenergic
antihypertensive agent. J. Hypert.1999. 17 (Suppl. 3): 41–54.
- Шевченко О. П., Праскурничий Е. А., Шевченко А. О. Метаболический
синдром. М.: Реафарм, 2004. 141 с.
О. П. Шевченко, доктор медицинских наук, профессор
Е. А. Праскурничий, кандидат медицинских наук
В. А. Жукова
РГМУ, КБ УД Президента РФ, Москва
Возросший интерес к проблеме метаболического синдрома у женщин в период
менопаузы обусловлен большим количеством фактических данных, свидетельствующих
о существенном влиянии его на развитие атеросклероза, а также тем, что за
последнее время заметно увеличилась его распространенность. Термин
«метаболический синдром» используют в том случае, когда у одного больного
имеется несколько факторов риска, таких, как артериальная гипертония (АГ),
инсулиновая резистентность, дислипидемия, абдоминальное ожирение, оказывающих
синергидное действие на процессы атерогенеза.
Распространенность сердечно-сосудистых заболеваний, в том числе АГ, у
мужчин в средних возрастных группах превышает таковую у женщин. Однако
наступление менопаузы сопровождается заметным ростом кардиоваскулярной
заболеваемости у женщин, что происходит на фоне неблагоприятных метаболических
изменений, выражающихся прежде всего в нарушениях липидного и углеводного
обмена. Начало менопаузы у женщин сопровождается снижением уровня эстрогенов и
ростом уровня андрогенов, что способствует увеличению массы тела. За последние
несколько десятилетий во всех странах наблюдается увеличение числа лиц,
страдающих ожирением, что сопровождается ростом распространенности
инсулинорезистентности и сахарного диабета (СД) 2 типа.
В ряде исследований было продемонстрировано, что резистентность тканей к
инсулину имеет важное значение в патогенезе АГ, возникающей у больных с
метаболическим синдромом. Длительная гиперинсулинемия, возникающая у больных с
инсулинорезистентностью, вызывает парадоксальную вазоконстрикцию, стимуляцию
симпатической нервной системы, увеличение объема циркулирующей крови за счет
увеличения реабсорбции ионов натрия и воды в дистальных канальцах нефронов.
Кроме того, инсулин является фактором, стимулирующим клеточный рост, поэтому
гиперинсулинемия способствует пролиферации сосудистых гладкомышечных клеток и
увеличению сосудистого сопротивления. Инсулин оказывает влияние на механизмы
трансмембранного ионного транспорта, и увеличение его концентрации приводит к
повышению внутриклеточной концентрации ионов натрия и калия, с чем связывается
повышение чувствительности гладкомышечных клеток артериол к прессорному
влиянию катехоламинов и ангиотензина II [1–4].
Сочетание АГ и инсулиновой резистентности у одного больного повышает
требования к медикаментозной терапии, которая в этих условиях, влияя на один
из компонентов метаболического синдрома, не должна усиливать действие другого.
Основные требования к препарату выбора для лечения АГ у женщин с
метаболическим синдромом в постменопаузе заключаются в том, что он должен
обладать выраженным антигипертензивным эффектом, способностью улучшать
метаболизм глюкозы, не ухудшать инсулиновую резистентность тканей,
ограничивать влияние на сердечно-сосудистую систему нейрогуморальных факторов,
снижать активность симпатической нервной системы, уменьшать задержку натрия и
воды, не ухудшать симптомы менопаузы.
В качестве антигипертензивных средств новой генерации, обладающих
указанными свойствами, рассматриваются агонисты I1-имидазолиновых
рецепторов. Как было продемонстрировано в ходе плацебоконтролируемого
исследования, проведенного N. De Luca, R. Izzo, D. Fontana и соавторами (2000)
и включавшего 72 пациента с АГ и избыточной массой тела, лечение агонистом I1-имидазолиновых
рецепторов моксонидином в течение 8 нед вызывало достоверное улучшение
чувствительности периферических тканей к инсулину [16].
Целью исследования стали сравнительная характеристика антигипертензивной
активности и влияния на показатели углеводного обмена агониста I1-имидазолиновых
рецепторов моксонидина (физиотенза) и β-адреноблокатора метопролола у женщин с
метаболическим синдромом в постменопаузальном периоде.
В исследование были включены 40 женщин, в возрасте от 48 до 58 лет (средний
возраст 55 ± 5,4 года), с увеличением массы тела (индекс массы тела (ИМТ) 32 ±
3 кг/м2), наличием АГ I–II степени (при измерении аускультативным
методом — систолическое АД (САД) составило 153,9±10 мм рт. ст.; диастолическое
АД (ДАД) — 95,7 ± 5 мм рт. ст.; по данным суточного мониторирования АД (СМАД)
среднесуточное САД составило 37±12,7 мм рт. ст., среднесуточное ДАД — 82,6 ± 9
мм рт. ст.), уровнем глюкозы натощак — 6,1 ± 0,9 ммоль/л. У всех женщин
наступила естественная менопауза и никто из них не получал
гормонозаместительную терапию. Больные были рандомизированы в группы лечения
моксонидином (физиотенз, Solvey Pharma) 0,2–0,4 мг/сут либо метопрололом
100–150 мг/сут. В первую группу вошла 21 больная, во вторую группу — 19
больных. В выделенных группах больные статистически достоверно не различались
по таким показателям, как возраст, длительность анамнеза АГ, масса тела.
Началу активного лечения предшествовал 2-недельный контрольный период, на это
время отменялась ранее назначенная антигипертензивная терапия. Включенные в
исследование пациентки получали моксонидин либо метопролол в виде монотерапии;
комбинации указанных препаратов с другими антигипертензивными средствами не
назначались.
Сбор анамнестических данных и клиническое обследование больных с анализом
проявлений менопаузальных симптомов проводились при включении пациенток в
исследование, а также в конце контрольного периода, через 2, 6 и 12 нед
терапии. При 3-м и 4-м визитах при уровне АД 140/90 мм рт. ст. и выше (по
данным казуальных измерений) дозу препаратов увеличивали до 0,4 мг моксонидина
и 150 мг метопролола в сутки.
Клиническое артериальное давление (АДкл.) определяли как среднюю величину
трех измерений АД ртутным сфигмоманометром по методу Короткова, выполненных в
положении обследуемого сидя после 5 мин отдыха в отсутствие терапии или спустя
2–3 ч после приема препарата.
СМАД проводилось с помощью прибора CardioTens-01 (Mediteck, Венгрия).
Средняя продолжительность мониторирования составила 24 ± ± 0,5 ч. В период с
10 до 22 ч АД регистрировалось каждые 15 мин, с 22 до 5 ч — каждые 30 мин, с 5
до 10 ч — каждые 10 мин.
При проведении СМАД оценивались такие параметры, как среднесуточный,
среднедневной, средненочной уровни САД и ДАД, а также показатели нагрузки
давлением (индекс времени и индекс площади гипертонии), вариабельности АД, и
вычислялся суточный индекс. Уровень среднесуточного АД более или равный 130 мм
рт. ст. для САД и более или равный 80 мм рт. ст. для ДАД рассматривался как
повышенный [6, 7].
Велоэргометрическая проба (ВЭМ) проводилась с целью определения характера
изменений АД в условиях динамической физической нагрузки. ВЭМ выполнялась
после мониторирования АД, при отсутствии противопоказаний к проведению
нагрузочной пробы, в утренние часы, после легкого завтрака, в положении лежа с
использованием метода ступенчато-возрастающей нагрузки. Исследование
проводилось исходно через 14 дней после отмены антигипертензивной терапии и на
фоне терапии препаратом, через 3–4 ч после приема его очередной дозы. Пробу
начинали с нагрузки 25 Вт, мощность нагрузки повышали на 25 Вт с интервалом в
3 мин. АД и ЧСС регистрировались исходно и с интервалом в 1 мин во время
нагрузки и в течение каждой минуты восстановительного периода. Мониторирование
электрокардиограммы в 12 стандартных отведениях проводилось в течение всей
пробы, регистрация — на 3 минуте каждой ступени нагрузки.
Для оценки гипертензивной реакции АД использовали критерии гипертензивной
реакции, которые заключались в повышении АД более 200/100 мм рт. ст. при ВЭМ
на фоне нагрузки 100 Вт и превышение предела 140/90 мм рт. ст. для АД на 5-й
минуте восстановительного периода [8].
Изометрическая проба проводилась следующим образом. С помощью динамометра
определяли максимальную силу в правой руке пациента. Затем в течение 3 мин
пациент сжимал динамометр с силой, составляющей 30 % от максимальной. АД и ЧСС
регистрировалось непосредственно перед пробой исходно и в конце 3-й минуты
сжимания динамометра. ЭКГ регистрировалось в течение 3 мин восстановительного
периода. Оценивались максимальные САД, ДАД, ЧСС, измеренные на высоте нагрузки
(в конце 3-й минуты), а также прирост САД, ДАД, ЧСС — разница максимального
САД, ДАД, ЧСС и исходных значений.
Оценка параметров углеводного обмена и инсулинемии включала в себя
проведение стандартного глюкозотолерантного теста (ГТТ) с параллельным
определением уровня глюкозы и инсулина в сыворотке крови натощак и на 30, 60 и
120-й минутах ГТТ.
Уровень глюкозы крови определялся стандартным глюкозооксидазным методом.
Уровень инсулина в сыворотке крови устанавливали радиоиммунологическим методом
с использованием стандартных наборов реактивов РИО-ИНС-ПГ1251. По результатам
проведенного исследования были рассчитаны интегральные показатели: площадь под
кривой глюкозы (ППКГ) и площадь под кривой инсулина (ППКИ) [10]. Расчеты
производили по методу суммы трапеций с применением следующих формул:
ППКГ = 1/2 х (Г30–Г0) х 30 + Г0 х 30 + 1/2 х (Г30–Г60) х 30 + Г60 х 30
+ 1/2 (Г60–Г120) х 60 + Г120 х 60,
где Г0 — уровень глюкозы в крови натощак; Г30, Г60, Г120 — уровни глюкозы в
крови через 30, 60 и 120 мин после нагрузки глюкозой;
ППКИ = 1/2 х (И30 — И0) х 30 + И0 х 30 + 1/2 х (И30 — И60) х 30 + + И60
х 30 + 1/2 (И60–И120) х 60 + И120 х 60,
где И0 — уровень инсулина в сыворотке крови натощак; И30, И60, И120 —
уровни инсулина в сыворотке крови через 30, 60 и 120 мин после нагрузки
глюкозой.
Статистический анализ проводили с помощью пакета программ Exсel 7.0 и
Statgraphics 2.1 с использованием рекомендованных критериев. Различия считали
достоверными при p < 0,05. Результаты представлены в виде M ± SD.
По данным клинического измерения АД, терапия моксонидином и метопрололом
характеризовалась положительным антигипертензивным эффектом (табл.). При этом
доля пациентов, у которых удалось достигнуть снижения АД до уровня менее
140/90 мм рт. ст. в группах моксонидина и метопролола существенно не
различалась и составила 71 и 80% соответственно. Межгрупповые различия по
изучаемым показателям как до лечения, так и спустя 3-месячный период терапии
были статистически недостоверны. Существенной динамики ЧСС в группе лиц,
получающих моксонидин, отмечено не было, тогда как на фоне приема
β-адреноблокатора данный показатель достоверно снизился.

Таблица. Динамика измерений АД и ЧСС на фоне терапии
моксонидином и метопрололом
Полученные результаты свидетельствуют о том, что оба препарата оказывают
сопоставимый антигипертензивный эффект, особенность которого заключалась в
преимущественном влиянии на уровень систолического АД в дневной период суток.
В настоящем исследовании не было отмечено достоверного влияния изучаемых
препаратов на такие показатели, как вариабельность АД, суточный индекс, индекс
гипертонии, индекс площади гипертонии, а также двойное произведение, что мы
объясняем отсутствием выраженных изменений данных параметров в обеих группах
исходно.
С целью оценки влияния препаратов на функционально-адаптационные
возможности кровообращения гемодинамические показатели регистрировались в ходе
проведения ВЭП. При этом были установлены значительные преимущества
β-адреноблокатора в отношении подавления гипертензивной реакции, возникающей в
условиях данного варианта стресс-тестирования. Подобный вывод можно было
сделать при анализе гемодинамических показателей, зарегистрированных уже при
мощности нагрузки 50 Вт.
С другой стороны, результаты пробы с изометрической нагрузкой не позволяли
однозначно судить о преимуществах метопролола и отражали сопоставимый эффект
сравниваемых препаратов в отношении подавления гипертензивной реакции.
В ходе исследования не было выявлено статистически значимого изменения
уровня гликемии на фоне приема как моксонидина, так и метопролола, что
отражает представленная на рисунке 1 динамика интегрального показателя ППКГ.
Тем не менее в группе лечения моксонидином отмечалась тенденция к уменьшению
(7,6 %), а в группе метопролола — повышение (3,6 %) уровня глюкозы в
сыворотке.

Рисунок 1. Динамика измений уровня глюкозы и инсулина в
крови (%) до лечения и на фоне приема метопролола и моксонидина через 12
недель терапии
Сравнительный анализ влияния препаратов на гиперинсулинемию — критерий
инсулинорезистентности — свидетельствовал о статистически достоверном снижении
уровня инсулина в плазме только в группе больных, получавших моксонидин (рис.
2). Это отражает важную сторону эффекта данного препарата, имеющую значение в
контексте патогенетической терапии артериальной гипертонии у лиц с
метаболическим синдромом.
Применение моксонидина и метопролола не сопровождалось развитием серьезных
побочных эффектов, требовавших отмены препарата; переносимость препаратов в
целом оценена как хорошая. У 3 больных на фоне приема моксонидина, отмечалось
появление сухости во рту, которая возникла в первые дни лечения и исчезла при
продолжении терапии. У 6 пациенток, получавших метопролол, наблюдались явления
мышечной слабости, нарушения сна, неприятные ощущения в нижних конечностях.
Принимая во внимание значение СД 2 типа для развития кардиоваскулярных
осложнений, разработка мероприятий, направленных на первичную профилактику
данного заболевания, является актуальной и чрезвычайно важной задачей. В
значительной мере успех ее решения при лечении больных с метаболическим
синдромом определяется эффектами антигипертензивных препаратов, и в частности
их способностью оказывать влияние на процессы углеводного и липидного обмена.

Рисунок 2. Сравнительная динамика инсулинемии на фоне
терапии метопрололом и моксонидином, по результатам расчета ППКИ
С этих позиций включение в терапию лиц, страдающих АГ, препаратов,
обладающих не только выраженной антигипертензивной активностью, но и
положительно влияющих на метаболический профиль, соответствует цели лечения
больных АГ [9].
Результаты настоящего исследования свидетельствуют о высокой
антигипертензивной эффективности как агониста I1-имидазолиновых
рецепторов моксонидина (физиотенза), так и β-адреноблокатора метопролола у
женщин с метаболическим синдромом в периоде постменопаузы. Данный контингент
больных можно рассматривать как категорию лиц, имеющих высокий риск развития
СД 2 типа и его кардиоваскулярных осложнений. Поэтому представляется важным
тот факт, что у большей части больных использование этих препаратов в режиме
монотерапии позволяет достигнуть целевых значений АД.
Результаты СМАД подтверждают вывод о том, что антигипертензивная активность
агониста I1-имидазолиновых рецепторов моксонидина (физиотенза) и
β-адреноблокатора метопролола сопоставимы. В ходе некоторых исследований
удалось [10, 11] продемонстрировать влияние β-адреноблокаторов и агонистов I1-имидазолиновых
рецепторов на среднедневной уровень диастолического АД. Отсутствие подобной
тенденции в нашем исследовании можно объяснить тем, что среди обследованных
больных были лица с исходно невысоким уровнем диастолического АД. О
положительном антигипертензивном эффекте исследованных препаратов
свидетельствуют также результаты нагрузочных проб (ВЭМ и пробы с
изометрической нагрузкой).
Тот факт, что большая выраженность антигипертензивного эффекта препаратов
совпадала с периодом максимальной активности нейрогуморальных систем, в
значительной степени определяет их клиническое значение. С другой стороны,
отсутствие чрезмерного снижения АД в периоды преимущественно вагусной
активности, позволяет использовать агонисты I1-имидазолиновых
рецепторов, наряду с β-адреноблокаторами в тех ситуациях, когда выраженный
гипотензивный эффект нежелателен (в частности, суточный профиль АД имеет вид
over-dipper).
Особенностью гемодинамической реакции в ответ на применение агониста I1-имидазолиновых
рецепторов моксонидина в дозах 0,2–0,4 мг/сут в сравнении с использованием
β-адреноблокатора метопролола следует считать отсутствие статистически
значимого урежения ЧСС. Отсутствие отрицательного хронотропного эффекта при
использовании агониста I1-имидазолиновых рецепторов при назначении
его в средних терапевтических дозах позволило ряду авторов сделать вывод о
большем значении снижения периферического сосудистого сопротивления в
механизме антигипертензивного действия моксонидина [12].
Важной стороной клинической эффективности агонистов I1-имидазолиновых
рецепторов является благоприятное влияние на показатели углеводного обмена,
которое уже было продемонстрировано в целом ряде исследований [13]. Однако в
краткосрочных исследованиях достоверного влияния препаратов данной группы на
метаболизм глюкозы выявить, как правило, не удается [14]. В нашем исследовании
изменения гликемии на фоне лечения агонистом I1-имидазолиновых
рецепторов и β-адреноблокатором были не достоверными, носили характер
тенденций, хотя и противоположных. Поэтому особое значение имело изучение
характера влияния данных групп препаратов на гиперинсулинемию, как основной
лабораторный маркер инсулинорезистентности.
При этом нами отмечено статистически достоверное снижение степени
гиперинсулинемии на фоне приема моксонидина и отсутствие подобного эффекта у
метопролола. Это указывает на уменьшение выраженности инсулинорезистентности
под влиянием терапии агонистом I1-имидазолиновых рецепторов
моксонидином и отражает корригирующее влияние данного препарата в отношении
основного звена патогенеза метаболического синдрома.
Механизм влияния моксонидина на состояние инсулинорезистентности тканей в
настоящее время до конца не изучен. Предполагается, что имеют место как
центральный, так и периферические эффекты препарата, связанные с влиянием на
имидазолиновые рецепторы в поджелудочной железе и других тканях. Кроме того,
моксонидин повышает чувствительность инсулиновых рецепторов, оптимизирует
процессы утилизации глюкозы, улучшает секрецию инсулина [15].
Результаты нашего исследования свидетельствуют также о хорошей
переносимости моксонидина при лечении им в течение нескольких месяцев. Это
особенно важно для оптимизации терапии женщин в климактерическом периоде,
имеющих проявления метаболического синдрома. На основании вышесказанного можно
сделать следующие выводы.
- Агонист I1-имидазолиновых рецепторов моксонидин (физиотенз)
при использовании в качестве монотерапии АГ I–II степени у женщин в период
постменопаузы, имеющих проявления метаболического синдрома, обладает высокой
антигипертензивной эффективностью, сопоставимой с таковой у
β-адреноблокатора метопролола. Это отражает динамика АД при клинических
измерениях, СМАД, а также его регистрация во время нагрузочных проб.
- Моксонидин (физиотенз) при длительном применении характеризуется хорошим
профилем безопасности и низкой частотой развития побочных эффектов.
- Применение моксонидина (физиотенза) в течение 3-месячного периода
сопровождается уменьшением выраженности резистентности тканей к инсулину,
что отражает положительная динамика инсулинемии.
При выборе средств антигипертензивной терапии для женщин с метаболическим
синдромом в период менопаузы необходимо учитывать влияние лекарственных
препаратов на обмен липидов и чувствительность тканей к инсулину. Поэтому
важное место в лечении таких больных должны занимать агонисты I1-имидазолиновых
рецепторов, обладающие выраженным антигипертензивным эффектом и повышающие
чувствительность тканей к инсулину.
Литература
- Kaplan N. M. The deadly quartet: upper-body obesity, glucose intolerance,
hypertriglyceridemia and hypertension //Arch. Intern. Med.1989;149 :
1514–1520.
- Зимин Ю. В. Происхождение, диагностическая концепция и клиническое
значение синдрома инсулинорезистентности или метаболического синдрома Х.
//Кардиология. 1998. № 6. С. 71–81.
- Williams B. Insulin resistance: the shape of things to come //Lancet.
1994; 344 : 521–524.
- Sowers J. R., Standley P. R., Ram J. L. et al. Hyperinsulinemia, insulin
resistance and hyperglycemia: contributing factors in pathogenesis of
hypertension and atherosclerosis // Am. J. Hypertens. 1993; 6 : 260–270.
- Ernsberger P., Damon T. H., Graff L. M. et al. Moxonidine, a centrally
acting anti-hypertensive agent, is a selective ligand for Il-imidazoline
sites. J Pharmacol Exp Ther 1993;264:172–82.
- Gerin W., Rosofsky M., Pieper C., Pickering T.G. A test of
reproducibility of blood pressure and heart rate variability using a
controlled ambulatory procedure. J. Hypertens. 1993, Oct; 11(10):1127–31.
- Staessen J. A., Fagard R. H., Lijnen P. J, Thijs L., Van Hoof R., Amery
A. K. Mean and range of the ambulatory pressure in normotensive subjects
from a meta-analysis of 23 studies. Am. J. Cardiol., 1991, Apr
1;67(8):723–7.
- Аронов Д. М., Лупанов В. . Функциональные пробы в кардиологии. М., 2002.
С. 132–134.
- 2003 European Society of Hypertension — European Society of Cardiology
guidelines for the management of arterial hypertension. Guidelines Committee.
J. Hypertension 2003; 21 (6): 1011–1053.
- Кашерининов Ю. Р., Шаварова Е. К., Шаваров А. А., Конради А. О., Шляхто
Е. В. Динамика показателей углеводного и липидного обмена у больных
гипертонической болезнью на фоне терапии рилменидином в сравнении с
атенололом//Артериальная гипертензия. 2004. Т. 10. №1. С. 28–32.
- Куликов А. Н., Бобров Л. А. Действие некоторых антигипертензивных
средств на суточный профиль артериального давления у больных гипертонической
болезнью//TERRA MEDICA nova. 2003. № 4. С. 3–7.
- Динамика показателей углеводного и липидного обмена у больных
гипертонической болезнью на фоне терапии рилменидином в сравнении с
атенололом//Артериальная гипертензия. 2004. Т. 10. № 1. С. 28–32.
- Friedman J. E., Ishizuka T., Liu S. et al. Anti-hyperglycemic activity
of moxonidine: metabolic and molecular effects in obese spontaneously
hypertensive rat//Blood Pressure, 1998 (Suppl. 3). 32–39.
- Prichard B., Graham B., Owens C. Moxonidine: a new antiadrenergic
antihypertensive agent. J. Hypert.1999. 17 (Suppl. 3): 41–54.
- Шевченко О. П., Праскурничий Е. А., Шевченко А. О. Метаболический
синдром. М.: Реафарм, 2004. 141 с.
www.medicusamicus.com

















 Новости
Новости 