Лiкування шлуночкових порушень ритму серця
Сичов О.С., д.м.н., професор, модератор робочої групи з порушень серцевого ритму Асоціації кардіологів України, керівник відділу аритмій серця
Гетьман Т.В., к.м.н., науковий співробітник
Інститут кардіології ім. акад. М.Д. Стражеска АМН України
Проблема шлуночкових порушень ритму (ШПР) посідає особливе місце в сучасній кардіології, що зумовлено як високою частотою самих ШПР, так i труднощами оцінки необхідності їх подолання. Упродовж десятиліть зусилля дослідників
були зосереджені на розробці засобів усунення спонтанних ШПР на основі глибокого вивчення електрофiзiологiчних механізмів формування аритмії. Відтак у 60-70-ті роки з'явилися нові та надзвичайно ефективні антиаритмiчні засоби, впроваджені нові методи
добору та оцінки ефективності терапії, зокрема холтерівське моніторування ЕКГ та внутрішньосерцеве електрофізіологічне дослідження. Вони забезпечили можливість точної кількісної оцінки ШПР, характеристики морфологічних особливостей і субстрату аритмії, цілеспрямованого добору лікування не лише при шлуночковій екстрасистолії (ШЕ), а й при життєво небезпечних шлуночкових тахікардіях (ШТ).
Переломною подією для клінічної аритмології стало наприкінці 80-х років узагальнення результатів багатоцентрових досліджень CAST. Виявилося, що усунення шлуночкової екстрасистолії потужними та ефективними
антиаритмічними засобами 1-го класу не давало змоги запобігти раптовій смерті і, більше того, супроводжувалося погіршенням довготривалого прогнозу хворих з постінфарктною дисфункцією міокарда, передусім за рахунок зростання небезпеки проявів аритмогенної
дії. Тому у 90-х роках кардинально змінилася стратегія лікування ШПР, були переглянуті показання до застосування антиаритмічних препаратів у різних категорій хворих на основі прогностичного аспекту оцінки ефективності терапії.
До найважливіших завдань ведення хворих з ШПР належать:
- усунення гемодинамiчних змін та симптомів, спричинених аритмією (у тих випадках, коли аритмія є симптомною);
- запобігання ШПР високих градацій, раптової серцевої смерті (РСС) i покращення довготривалого прогнозу (у тих випадках, коли наявні маркери ризику РСС).
У багатьох випадках ШПР не супроводжуються клінічними симптомами, а усунення аритмії далеко не завжди доцільне з огляду на ризик раптової серцевої смерті. Відтак до початку терапевтичних заходів першим кроком лікаря є оцінка клiнiко-гемодинамiчного та прогностичного значення аритмії у конкретного хворого.
Клiнiко-гемодинамiчне значення ШПР полягає у здатності спричиняти симптоми i синдроми, які або безпосередньо пов'язані з порушеннями гемодинамiки (синкопальнi стани, стенокардія, серцева недостатність, артеріальна гіпотензія і колапс), або не погіршують стану гемодинаміки, але негативно впливають на якість життя хворого (запаморочення, нудота, тривога, iнодi страх i передсинкопе). Втім, дуже часто ШПР протікають безсимптомно.
Детальне збирання анамнезу i обстеження хворого дає змогу встановити прогностичне значення ШПР, яке певною мірою пов'язано з клініко-гемодинамічним, але не завжди відповідає наявній симптоматиці. Зокрема, в окремих випадках прогностично незначущі ШПР можуть супроводжуватися інвалідизуючими симптомами. З іншого боку, безсимптомнi
ШПР у хворих з тяжкими структурними ураженнями мiокарда (передусім, постінфарктним кардіосклерозом і/або серцевою недостатністю) істотно погіршують прогноз. У хворих з систолічною дисфункцією міокарда і СН прогноз виживання залежить від градації аритмії: поява ШЕ
відображає тяжкість ураження серцевого м'яза і є своєрідним маркером "помираючого серця", а ШПР високих градацій - ще й свідченням зростання імовірності раптової аритмічної смертi.
Сучасна комплексна оцінка прогнозу хворих з ШПР вимагає синтезу усієї наявної
інформації не лише про характер самого порушення ритму, а й про основне захворювання - етіологічний фактор ШПР. Вона починається вже при опитуванні та об'єктивному оглядi i є одним з основних завдань подальшого iнструментального обстеження хворих з ШПР (табл. 1).
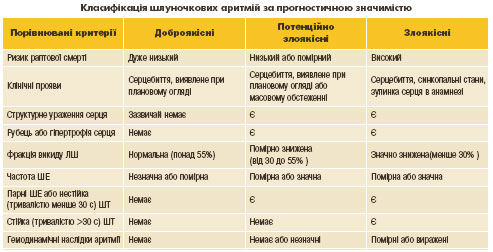
Наголосимо, що обов'язковим елементом обстеження хворих та оцінки прогностичного значення аритмії є ехокардіографічне дослідження, яке забезпечує важливу інформацію про структурне ураження серця, наявність рубцевих змін міокарда і гіпертрофії, а також ступінь дисфункції ЛШ.
ШПР вважають доброякiсними, якщо вони не спричинюють порушень гемодинамiки, не пов'язанi зі структурним ураженням серцевого м'яза i є низької градацiї (поодинокі ШЕ). ШПР розцінюють як доброякiсні приблизно у 30 % усiх хворих з симптомними шлуночковими аритмiями.
Потенцiйно злоякiснi ШПР пов'язанi з структурною патологiєю мiокарда,
дисфункцiєю серцевого м'яза, але також не викликають iстотних гемодинамiчних симптомiв. Потенцiйно злоякiсними можуть бути ШПР будь-яких градацій, за винятком стійкої ШТ. До цього класу належать близько 65 % усiх випадків ШПР.
Злоякiснi ШПР майже завжди виникають на фоні тяжкої структурної патології і дисфункцiї мiокарда, спричиняють значущі гемодинамiчнi порушення i є високої градацiї (звичайно це пароксизми стійкої ШТ). До злоякiсних належать до 5 % усіх випадків ШПР.
З метою встановлення частоти i градацiї аритмії у хворих з частими ШПР
достатньо зареєструвати звичайну ЕКГ. Показанням для здійснення холтерiвського монiторування ЕКГ з дiагностичною метою є перiодичне виникнення нападів сильного серцебиття, синкопальних станiв нез'ясованої етiологiї та iнших симптомiв, ймовірно зумовлених тахіаритмiєю,
не зареєстрованою на ЕКГ. Холтерівський моніторинг використовується не тільки для верифікації ризику РСС, а і для оцінки ефекту антиаритмічної терапії. Найчастіше в клінічній практиці використовуються критерії ефективності антиаритмічної терапії, які були запропоновані Хоровіцем та Лауном:
- Зменшення на 50% загальної кількості ШЕ;
- Зниження на 90% парних ШЕ;
- Повне зникнення пробіжок ШТ.
Однак, зазначимо, що з огляду на результати низки контрольованих дослiджень протягом останнього десятиліття були переглянутi принципи оцiнки ефективностi антиаритмiчної терапії методом холтерiвського
монiторування ЕКГ. Незважаючи на сильну кореляцiю мiж ризиком РСС i кiлькiстю та градацiєю зареєстрованих ШЕ у пацієнтів із структурним захворюванням серця, цей метод не виявився надiйним iндикатором ефективного усунення аритмiї, якiй притаманнi iстотнi спонтаннi коливання.
Як засвідчило дослідження ESVEM, у пацієнтів, які перенесли ІМ, навiть при нiбито ефективному подоланнi злоякiсних ШТ антиаритмiчними засобами у 50% випадкiв вони вiдновлювалися вже протягом наступних двох рокiв. Але ще бiльш небезпечним було те, що водночас з успiшним пригнiченням ШПР певними препаратами класу IC збiльшувався ризик РСС у тривалi термiни пiсля початку лiкування. Ці
дані отримані в дослідженнях CAST, CAST-II та ESVEM. Отже, поширена протягом 80-х років гіпотеза про можливість запобігання РСС у пацієнтів з ШПР шляхом усунення тригерів - передчасних шлуночкових скорочень - не була підтверджена. З іншого боку, препарати з
групи b-адреноблокаторів, власне антиаритмічна ефективність яких щодо подолання ШЕ відносно слабка, виявили здатність зменшувати ризик РСС у різних категорій пацієнтів та запобігати аритмогенній дії препаратів 1-го класу.
Результати холтерівського монiторування ЕКГ не відображають реальних змін
ризику РСС і обмежено iнформативнi для оцiнки ефективностi антиаритмiчної терапiї. Саме тому в бага-тьох клінічних ситуаціях антиаритмічні засоби, передусім аміодарон і/або b-адреноблокатори, призначаються емпірично і без урахування власне антиаритмічної
ефективності терапії.
В групах доведеного високого ризику РСС (передусiм у постінфарктних пацiєнтiв з шлуночковими порушеннями ритму) упродовж останнього десятилiття було проведено кiлька великих багатоцентрових рандомiзованих
дослiджень, якi дозволили встановити мiсце рiзних антиаритмiчних медикаментiв та пристроїв у первиннiй i вториннiй профiлактицi РСС. Єдиним антиаритмічним засобом, для якого отримано докази доцільності застосування для первинної профілактики РСС, залишається аміодарон. Найбільш відомим став мета-аналіз ATMA - сукупний аналіз 13 рандомізованих досліджень, здійснених протягом 90-х
років, в яких оцінювався ефект аміодарону порівняно з плацебо в пацієнтів після перенесеного ІМ (8 досліджень) і з СН (5 досліджень) та шлуночковими порушеннями ритму. Усього було проаналізовано результати лікування 6553 пацієнтів. Було встановлено, що ризик РСС при
тривалому (протягом двох років) застосуванні аміодарону вірогідно зменшився на 29%, а загальна смертність - на 13%. Серед побічних ефектів аміодарону найчастіше (до 4% випадків тривалого застосування препарату) спостерігали розлади з боку щитовидної залози, значно
рідше - нейропатії, появу легеневих інфільтратів, брадикардії або порушень функції печінки. Зважаючи на це, аміодарон показаний для первинної профілактики РСС передусім у тих пацієнтів із структурним захворюванням серця, в яких наявні критерії високого ризику життєво небезпечних аритмій серця і користь застосування препарату безперечно перевищує ризик побічних ефектів (табл.2).
Що стосується b-адреноблокаторів, то необхідно підкреслити, що ефективність в плані попередження РСС доведена для метопрололу, бісопрололу та карвіделолу.
Сучасним шляхом запобігання РСС з найбільш переконливими доказами ефективності у пацієнтів з груп високого ризику є імплантація ІКД. Наприклад, у дослідження MADIT включили 196 пацієнтів з ФВ ЛШ
35% після перенесеного ІМ, нестійкою ШТ, документованою при холтерівському моніторуванні ЕКГ або пробі з фізичним навантаженням, а також стійкою ШТ, яка індукувалась при електрофізіологічному дослідженні.
Рандомізовано здійснювали імплантацію ІКД або продовжували звичайне медикаментозне лікування. Протягом 27-місячного спостереження смертність у групі хворих з імплантованим ІКД становила 15%, медикаментозного лікування - 38% (хоча необхідно зазначити, що частина хворих
в цій групі приймала антиаритмічні препарати (ААП) 1-го класу). У цьому дослідженні було вперше доведено доцільність імплантації ІКД у постінфарктних пацієнтів з високим ризиком раптової аритмічної смерті.
Алгоритми диференцiйованого ведення хворих з ШПР
Ведення хворих з ШПР обов'язково передбачає корекцiю способу життя, дiєтичні заходи, лiкування основного захворювання, а також спроби усунення усiх можливих сприяючих факторів аритмії, в тому числі препаратів, які
в певних умовах можуть призводити до виникнення та посилення аритмій. Лише при неефективності цих заходів починають антиаритмiчну терапiю.
У хворих з доброякiсними ШПР єдиною метою лiкування ШПР є усунення симптомiв, якi негативно впливають на якiсть життя хворих; відтак, коли немає скарг, антиаритмiчну терапiю призначати недоцiльно. В
протилежному випадку препаратами вибору передусім є седативнi засоби і b-адреноблокатори (пропранолол 60-80 мг на добу, або метопролол 50-100 мг на добу), лiкування якими пов'язане з найменшим ризиком кардіальних побічних ефектів. Критерiєм подальшого вибору при їх
неефективностi, зважаючи на відносно незначний ризик аритмогенних проявів у цієї категорії хворих, є ризик екстракардiальних побiчних ефектiв. Відтак доцiльно застосовувати пропафенон (450-600 мг на добу), який поєднує властивостi класу 1С i b-адреноблокаторів, або етмозин (400-800 мг на добу). Ці препарати ефективні i менш токсичні, нiж препарати класiв 1A i 1B.
Мета лiкування при потенцiйно злоякiсних ШПР - не лише усунення аритмiї, а й покращання прогнозу хворих. У багатьох хворих з серцевою недостатністю зменшення кiлькостi ШПР за даними холтерiвського монiторування ЕКГ досягають вже при традиційному лiкуваннi ІАПФ, якi достовiрно покращують довго-
тривалий прогноз. Певне значення має також корекцiя рiвнів калiю і магнію в кровi, особливо на фонi терапiї петльовими або тіазидовими дiуретиками. При неефективностi цих заходiв обережно
використовують b-адреноблокатори або аміодарон. За відсутності протипоказань b-адреноблокатори обов'язково рекомендують хворим, які перенесли гострий iнфаркт мiокарда, оскільки ці препарати запобігають РСС і поліпшують виживання хворих. Проте доза їх у цьому
випадку вища, ніж при лікуванні доброякісних аритмій (пропранолол 80-120 мг на добу). При частих клінічно виражених ШПР у хворих після перенесеного ІМ за недостатньої ефективності b-адреноблокаторів найбезпечнішими з огляду на ризик аритмогенних проявів є соталол (160-240, інколи
320 мг на добу) і аміодарон. Звичайно доза аміодарону при тривалому застосуванні не повинна перевищувати 200-300 мг на добу, що дозволяє істотно зменшити ризик екстракардіальних побічних ефектів препарату. Лише при неефективності цих ліків оцінюють ефективність антиаритмічних засобів 1-го класу, причому перевагу надають менш аритмогенним препаратам класів IА і IВ.
Засобами вибору для припинення пароксизму мономорфної ШТ є новокаїнамід або аміодарон внутрішньовенно. При злоякiсних ШПР у хворих з тяжкою дисфункцією ЛШ безперечним препаратом вибору є аміодарон, можливо, в комбінації з малими дозами b-адреноблокаторів (метопролол 6,25-25мг, інколи 50 мг тричі на добу) і, звичайно, в
поєднанні з ІАПФ. Доза аміодарону в перiод насичення становить 600-1200 мг на добу, далi її зменшують до мiнiмальної ефективної. За відсутності ознак тяжкої дисфункції міокарда і/або СН можна застосувати соталол у терапевтичній дозі (160-320 мг на добу). При неефективності
або протипоказаннях до цих препаратів оцінюють ефективність антиаритмiчних засобів класiв 1A або 1B (лiдокаїну, мексилетину, новокаїнамiду, дизопiрамiду, хінідину) і лише потім - препаратів класу 1C. Наголосимо, що дотепер у жодному з виконаних дослiджень антиаритмiчнi препарати 1-го класу не покращили довготривалого прогнозу хворих iз злоякiсними ШПР.
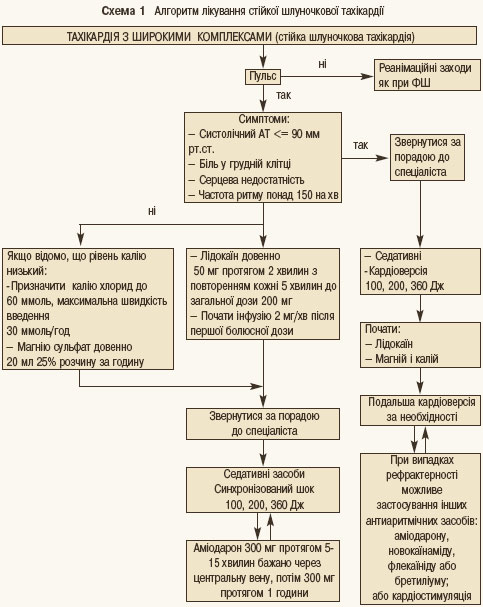
При пароксизмах ШТ, які супроводжуються вираженими порушеннями гемодинамiки (набряком легень, кардiогенним шоком, втратою свiдомостi), засобом вибору є електрична кардiоверсiя. Алгоритм, рекомендований Європейським кардіологічним товариством, визначає тактику лікування пароксизму стійкої ШТ залежно від наявності проявів порушення гемодинаміки, рівня електролітів у крові, ефективності медикаментів та електричної кардіоверсії (схема 1).
У розвинутих країнах широко застосовують радикальнi, немедикаментознi методи лiкування злоякісних ШПР: радiочастотну абляцiю ектопiчних вогнищ та iмплантацiю ІКД.
Чи доцільно застосовувати антиаритмічні засоби для підвищення ефективності реанімаційних заходів при зупинці серця, особливо у випадках, коли після дефібриляції не вдається відновити синусовий ритм серця?
Безперечно, брак переконливих даних щодо ефективності антиаритмічних препаратів за умов серцево-легеневої реанімації зумовлений особливостями клінічної ситуації та труднощами організації контрольованих досліджень. Проблема полягає також у тому, що препарати можуть
бути ефективними, але не досягати клітинних мембран, де реалізується їх фармакологічна дія, через неадекватне кровопостачання життєво важливих органів. Першим препаратом, для якого отримані адекватні докази ефективності при зупинці серця, став аміодарон. У 1999 році в Сполучених Штатах закінчилось унікальне за своїм дизайном плацебоконтрольоване дослідження ARREST, яке здійснювалось у "польових"
умовах, поза стаціонарами. Пацієнтам з зупинкою серця внаслідок ФШ або ШТ після триразової дефібриляції ще до поступлення в клініку рандомізовано внутрішньовенно вводили аміодарон 300 мг (n=246) або плацебо (n=258). Застосовувались також всі стандартні заходи серцево-легеневої реанімації, включаючи, за необхідності, введення інших антиаритмічних засобів.
Первинною кінцевою точкою дослідження було виживання пацієнтів при поступленні в госпіталь. Цей показник становив 44% пацієнтів після введення аміодарону і 34% - в групі плацебо. Отже, відносне поліпшення
прогнозу виживання становило майже 30%, абсолютне - 10%, що було статистично вірогідним (р=0.03). Це означає, що при застосуванні аміодарону в 10 пацієнтів з зупинкою серця, рефрактерною до повторних електричних дефібриляцій, вдалося додатково врятувати до поступлення в
госпіталь одного пацієнта. Наголосимо, що призначення аміодарону було ефективним, незважаючи на частіше виникнення гіпотензії і брадикардії в групі активного лікування порівняно з плацебо. До цього часу не встановлено, чи дозволяє введення аміодарону покращувати довготривалий прогноз виживання пацієнтів, які перенесли зупинку серця. Втім, зважаючи на результати дослідження ARREST, у 2000
році в алгоритми серцево-легеневої реанімації при фібриляції шлуночків включили рекомендацію вводити аміодарон у доповнення до стандартних реанімаційних засобів. Аміодарон - єдиний антиаритмічний препарат, рекомендований зараз для внутрішньовенного застосування при рефрактерності до повторних процедур електричної дефібриляції серця.
Таким чином, протягом останнього десятиліття здійснено багато контрольованих досліджень, які дозволили встановити місце антиаритмічних препаратів, пристроїв і довели, зокрема, переваги b-адреноблокаторів,
аміодарону й автоматичних внутрішніх кардіовертерів-дефібриляторів у первинній та вторинній профілактиці РСС у пацієнтів з кардіологічними захворюваннями, передусім з інфарктом міокарда і серцевою недостатністю. Було істотно вдосконалено стратегію лікування
шлуночкових аритмій на основі ретельної індивідуалізованої оцінки клiнiко-гемодинамiчного та прогностичного значення порушення ритму, порівняння потенційної користі лiкування та можливого ризику кардiальних i екстракардiальних побічних ефектів, даних щодо здатності
антиаритмiчних препаратів покращувати довготривалий прогноз виживання хворих та викликати небезпечну аритмогенну дію. Але, незважаючи на ці визначні досягнення експериментальної та клінічної медицини, реальний рівень пізнання стану проблеми залишає цілу низку невирішених питань.
Литература
- Aguiar C, Ferreira J, Seabra-Gomes R. Prognostic value of continuous ST-segment monitoring in patients with non-ST-segment elevation acute coronary syndromes // Ann Noninvasive Electrocardiol. - 2002. - Vol. 7(1). - p. 29-39.
- Bayes De Luna A., Coumel P., Leclerq J.F. Ambulatory sudden cardiac death: mechanism of production of fatal arrhythmia on the basis of data from 157 cases // Am.Heart J. - 1989. - Vol. 117. - P. 151-159.
- Cappato R. Secondary prevention of sudden death: the Dutch study, the antiarrhythmics versus implantable defibrillator trial, the cardiac arrest study Hamburg and the Canadian implantable defibrillator study (review)// Am J Cardiol. -1999. - Mar 11. -Vol. 83 (5B). - P. 68D-73D.
- Chevalier P, Kirkorian G, Touboul P.Arrhythmic sudden cardiac death due to coronary artery spasm // Card Electrophysiol Rev. - 2002. - Vol.6(1-2). - P. 104-106.
- Cohen M., Stinett S.S., Weatherley B.D. at al. Predictors of recurrent ischiemic events and death in unstable coronary artery disease after treatment with combination antithrombotic therapy // Am Heart J.- 2000. - Vol.139. - P. 962-970
- Disertori M, Dallafior D, Marini M. Arrhythmia risk stratification based on etiological and anatomo-structural factors // Ital Heart J.- 2001. - Vol.2 (12 Suppl). - P. 1265-1269
- Elliott P.M., Poloniecki J, Dickie S et al. Sudden death in hypertrophic cardiomyopathy: identification of high risk patients // J Am Coll Cardiol. - 2000. Vol. 36. - P. 2212-2218
- Florenciano-Sanchez R, Castillo-Moreno JA, Molina-Laborda E,
Jimenez-Pascual M, Garcia-Urruticoechea P, Egea-Beneyto S, Sanchez-Villanueva JG, Ortega-Bernal J. The exercise test that indicates a low risk of events. Differences in prognostic significance between patients with chronic stable angina and patients with unstable angina // J Am Coll Cardiol.- 2001. - Vol. 38(7), - P. 1974-1979.
- Goldstein M.R.Sudden death due to cardiac arrhythmias //
N Engl J Med. - 2001 Vol. 15.- P. 1473-1482.
- Hohnloser S.H., Klingenheben T., Zabel M. Identification of patients after myocardial infarction at risk of life-threatening arrhythmias // Eur. Heart J. - 1999. - V. 1 (Supplement C). - C11-C20
- Huikuri H.V., Castellanos A, Myerburg R.J. Sudden death due to cardiac arrhythmias // N Engl J Med. - 2001. - Vol. 15.- N 345(20). - P. 1473-1482.
- Jouven Xavier, Desnos Michel, Guerot Claude et al. Predicting Sudden Death in the Population. The Paris Prospective Study I. // Circulation. -1999. - Vol. 99. - P. 1978-1983
- Jordaens L, Taverbnier R. Determinants of sudden death after discharge from hospital for myocardial infarction in the thrombolytic era //Eur Heart J. - 2001. -Vol. 22. - P.1214-225.
- Lanza G.A., Guido V., Galeazzi M.M., et al. Prognostic role of heart rate variability in patients with a recent acute myocardial infarction // Am. J. Cardiol. - 1998. - Vol. 82. - P. 1323-1328.
- Lombardi F. Arrhythmia risk stratification in patients with heart failure: prognostic evaluation of arrhythmia risk // Ital Heart J. - 2001. - Vol.2(12 Suppl). - P. 1284-1290.
- Mark Estes NA 3rd, Homoud MK, Link MS, Wang PJ. Assessment of risk for sudden cardiac death // Curr Probl Cardiol 2002 Jun;27(6):246-266.
- Moncrieff J, McGavigan A.D., Dunn. Arrhythmias, sudden death and syncope in hypertensive cardiovascular disease // FG.Card Electrophysiol Rev. - 2002. - Vol. 6(1-2). - P. 36-41.
- Priori S.G., Aliot E., Blomstrom-Lundqvist C. et al: Task force on sudden cardiac death of the European Society of cardiology.// European Heart Journal - 2001. - Vol. 22. - P. 1374-1450.
- Priori S.G., Aliot E., Blomstrom-Lundqvist C. et al: Task force on sudden cardiac death of the European Society of cardiology.// European Heart Journal - 2001. - Vol. 22. - P. 1374-1450.
- Runquist L, Hendrix G.Survival and prognosis following sudden cardiac death // J S C Med Assoc. - 2001. - Vol. 97(10). - P. 439-441.
- Sabatine M.S., McCabe C.H., Morrow D.A., Giugliano R.P., de Lemos J.A., Cohen M, Antman E.M., Braunwald E. Identification of patients at high risk for death and cardiac ischemic events after hospital discharge // Am Heart J.- 2002. - Vol.143(6). - P. 966-970
- Saeed M, Homoud M.K. Wang P.J. Role of invasive electrophysiologic testing in risk stratification for sudden cardiac death // J Invasive Cardiol. - 2001. Vol. 11. - P. 758-762.
- Spirito P, Bellone P, Harris K.M., Bernabo P, Bruzzi P, Maron B.J. Magnitude of left ventricular hypertrophy and risk of sudden death in hypertrophic cardiomyopathy // N Engl J Med. - 2000. - Vol. 342. - P. 1778-1785.
- The Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. // N. Engl. J. Med. - 1989. -Vol. 331. - P. 406-412.
- Wong S.H., Mulvihill N.T., Norton M.Assessing the risk of sudden cardiac death // Heart. - 2001.- Vol.86(6). - P.624-625.
- Zareba W. J. New electrocardiographic indices of risk stratification // Electrocardiol. - 2001. - Vol. 34(4). - P.332-339.
- Zheng Z.J., Croft J.B., Giles W.H., Mensah G.A..Sudden cardiac death in the United States, 1989 to 1998 // Circulation. - 2001. - Vol. 30;104(18). - P. 2158-2163.
- Zipes D.P. Citizens of the world // J Am Coll Cardiol. - 2002. - Vol 9. - P.1411-1413.
Medicus Amicus, №1 2006
|









 Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог..
Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог.. включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн..
включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн.. Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп..
Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп.. Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас..
Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас.. Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..
Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..


 Новости
Новости 