Роль карбапенемов в условиях эскалации антибиотикорезистентности грамотрицательных бактерий
Введение
Карбапенемы (имипенем, меропенем и эртапенем)1 являются антибиотиками с наиболее широким спектром активности, что выгодно отличает их от многих других классов антимикробных препаратов. Они проявляют быстрое бактерицидное действие в отношении грамположительных и грамотрицательных аэробных и анаэробных бактерий. Природной устойчивостью к карбапенемам обладают метициллинрезистентные стафилококки, Enterococcus faecium, Stenotrophomonas maltophilia. У имипенема в 2–4 раза выше активность in vitro против метициллинчувствительных стафилококков, Streptococcus pneumoniae и Enterococcus faecalis, а меропенем в 4–64 раза превосходит имипенем по действию на грамотрицательные бактерии, что имеет особое значение в отношении Pseudomonas aeruginosa – самого частого возбудителя инфекций в отделениях реанимации и интенсивной терапии (ОРИТ) [1,2]. Карбапенемы проявляют равную антианаэробную активность, более высокую по сравнению с метронидазолом, клиндамицином, цефокситином [3]. Эртапенем в отличие от имипенема и меропенема не действует на неферментирующие бактерии (P. aeruginosa и Acinetobacter spp.) [4] и характеризуется высоким связыванием с белками сыворотки крови, что увеличивает период его полувыведения до 4 часов по сравнению с 1 часом у антисинегнойных карбапенемов [5].
Нерациональное использование карбапенемов в рутинной практике без учета объективных показаний, помимо экономической нецелесообразности, может сопровождаться формированием и селекцией полирезистентных штаммов бактерий, когда любые антимикробные препараты становятся неэффективными. Поэтому при назначении эмпирической терапии при тяжелых инфекциях возникает дилемма между необходимостью максимально широкого охвата потенциальных возбудителей для обеспечения адекватного лечения, с одной стороны, и минимизацией селекции антибиотикорезистентных штаммов, с другой стороны. Следует также учитывать региональные и локальные данные мониторинга приобретенной устойчивости ведущих возбудителей внебольничных и госпитальных инфекций, и в первую очередь уровень продуцентов b–лактамаз расширенного спектра (БЛРС) среди грамотрицательных патогенов, представляющих наибольшую угрозу, так как они гидролизуют практически все цефалоспорины и широко распространены в России. К числу проблемных микроорганизмов относятся P. aeruginosa и Acinetobacter spp., которые могут приобретать устойчивость к имипенему и реже – к меропенему. Важная роль в достижении максимальной клинической и микробиологической эффективности карбапенемов принадлежит рациональному их дозированию с учетом фармакокинетических и фармакодинамических (ФК/ФД) параметров, о чем наглядно свидетельствуют результаты изучения меропенема с помощью математического моделирования. Рассмотрению этих и смежных вопросов с акцентом на меропенем посвящена настоящая публикация.
Характеристика бета–лактамаз (БЛ)
и рекомендации по выявлению БЛРС
Продукция БЛ является ведущим механизмом формирования резистентности к b–лактамным антибиотикам у грамотрицательных бактерий. Все известные в настоящее время БЛ (более 300 разновидностей) делят на 4 молекулярных класса, в пределах которых ферменты характеризуются общностью свойств и выраженной гомологией, а также чувствительностью или резистентностью к действию ингибиторов – клавулановой кислоты, сульбактама, тазобактама [6]. Ферменты класса В относятся к металлоэнзимам, поскольку в качестве кофермента в них присутствует атом цинка. БЛ классов А, С, D относятся к ферментам «серинового» типа (по аминокислоте, находящейся в активном центре фермента).
Внутри класса А выделены 7 групп [6], из которых повышенное внимание в настоящее время уделяют группе 2be, где сосредоточена большая часть ферментов, обозначенных под термином «бета–лактамазы расширенного спектра» (БЛРС). В отличие от ранее известных «бета–лактамаз широкого спектра», гидролизирующих природные и полусинтетические пенициллины, цефалоспорины I и отчасти II поколения, БЛРС дополнительно гидролизуют цефалоспорины III и IV поколений (не затрагивая цефамицины2). Они сохраняют чувствительность к действию ингибиторов, а продуцирующие их бактерии (чаще K. pneumoniae и E. coli) отличаются ассоциированной резистентностью к другим антибиотикам: гентамицину – до 80%, ципрофлоксацину – 40–60% [7]. Ответственные за синтез БЛРС гены локализованы на плазмидах, которые реплицируются автономно в цитоплазме бактериальной клетки и способны передаваться большому числу других особей как внутри вида, так и путем межвидовой и межродовой передачи. Этот процесс носит эпидемический характер, а антибиотики способствуют селекции резистентных клонов бактерий. Факторами риска распространения БЛРС являются:
• предшествующая терапия цефалоспоринами III поколения [8] (их чрезмерное потребление в течение длительного времени также ведет к вспышкам инфекций, обусловленных метициллинрезистентными стафилококками [9]);
• применение артериальных, центральных венозных и мочевых катетеров;
• оказание медицинской помощи в ОРИТ, крупных больницах (более 500 коек), учреждениях социальной защиты.
По данным многоцентрового исследования MYSTIC, среди стран Европы наибольшую частоту распространения БЛРС стабильно отмечают в России и Польше (до 40% среди всех изученных энтеробактерий) [10]. В отдельных лечебных учреждениях РФ частота продукции БЛРС среди Klebsiella spp. превышает 90% [11].
Согласно зарубежным публикациям имипенем и меропенем в равной степени сохраняют активность против энтеробактерий, продуцирующих БЛРС [12, 13], что подтверждают и российские исследователи [14] (табл. 1).
Согласно рекомендациям NCCLS, штаммы E. coli и Klebsiella spp., продуцирующие БЛРС, должны рассматриваться как устойчивые к пенициллинам, цефалоспоринам (кроме цефамицинов), азтреонаму [15], а лечение соответствующих инфекций цефалоспоринами III–IV поколения неэффективно и ведет к дальнейшему распространению БЛРС.
Выявление штаммов, продуцирующих БЛРС, невозможно осуществить рутинными методами оценки антибиотикочувствительности, поэтому часто пользуются косвенными признаками. Если выделен госпитальный штамм клебсиеллы или кишечной палочки, устойчивый при определении диско–диффузионным методом хотя бы к одному из трех антибиотиков – цефотаксиму, цефтриаксону или цефтазидиму, то не следует назначать цефалоспорины, а наиболее надежными средствами в этом случае являются карбапенемы.
В таблице 2 представлены критерии чувствительности K. pneumoniae и E. coli к цефалоспоринам, позволяющие рассматривать штаммы этих микроорганизмов как подозрительные на продукцию БЛРС.
В качестве подтверждающих тестов используют стандартные диски с обычным содержанием цефотаксима и цефтазидима (по 30 мкг на диск) и диски, содержащие комбинации каждого из этих антибиотиков с клавулановой кислотой (30 мкг цефалоспорина + 10 мкг клавуланата). Микроорганизм считается продуцентом БЛРС, если зона задержки роста вокруг диска с комбинацией цефалоспорина и клавуланата на 5 мм и более превышает диаметр зоны вокруг диска с цефалоспорином. Для положительного результата достаточно выявить различия хотя бы для одной пары дисков.
В методе серийных разведений в бульоне микроорганизм считается продуцентом БЛРС, если значение МПК в присутствии клавуланата на 3 и больше разведений уступает соответствующему значению МПК цефалоспорина без клавуланата.
Достаточно демонстративным является метод двух дисков. На чашку Петри с агаром Mueller–Hinton, предварительно засеянным исследуемым микроорганизмом, накладывают диск с амоксициллином/клавуланатом, а на расстоянии 30 мм от него – диск с одним из цефалоспоринов III поколения (расстояние измеряется от центра дисков). Возможны варианты наложения 2 и 3 дисков с различными цефалоспоринами (и азтреонамом) вокруг диска с амоскициллином/клавуланатом. Если микроорганизм продуцирует БЛРС, зона ингибиции роста вокруг диска с цефалоспорином окажется «вытянутой» в сторону диска с амоксициллином/клавуланатом или происходит слияние зон. Причиной наблюдаемого эффекта является подавление роста микроорганизма в той зоне, куда диффундируют и клавуланат, и цефалоспорин (рис. 1).
БЛ класса С относятся к наиболее распространенным ферментам с хромосомной локализацией генов (AmpC), которые обнаруживаются практически у всех грамотрицательных бактерий. В отличие от плазмидных БЛРС они не передаются другим энтеробактериям и характеризуются индуцибельностью и гиперпродукцией, возникающей на фоне лечения. Общими свойствами этих ферментов являются: способность гидролизовать пенициллины и цефалоспорины I–III поколения; устойчивость к действию ингибиторов; чувствительность к цефалоспоринам IV поколения и карбапенемам.
Для бактерий группы Enterobacter, Serratia, Morganella, P. aeruginosa характерен индуцибельный тип экспрессии генов. При отсутствии в среде антибиотиков фермент практически не вырабатывается, но после контакта с некоторыми b–лактамами, в частности, с цефтазидимом, скорость синтеза резко возрастает [16], что может сопровождаться селекцией ванкомицинрезистентных энтерококков [17]. При нарушении регуляторных механизмов возможна постоянная гиперпродукция фермента. Мощным индуктором хромосомных БЛ класса С является имипенем [18], поэтому его применение нередко ведет к селекции штаммов, устойчивых к цефалоспоринам III поколения. Согласно международному исследованию MYSTIC распространенность индуцибельных AmpC штаммов в России и Польше одинаково высока и достигает 30% (в других странах Европы этот показатель находится в пределах 5–9%) [19].
Значение представителей других классов БЛ не столь существенно, поскольку цефалоспорины III–IV поколений наряду с карбапенемами в подавляющем большинстве случаев сохраняют свою активность.
Механизмы формирования
резистентности к карбапенемам
Механизмы резистентности микроорганизмов к карбаренемам сходные, исключением является P. aeruginosa. Карбапенемы проникают в клетку через особые белковые структуры внешней мембраны – пориновые каналы. Наиболее частым механизмом устойчивости синегнойной палочки к имипенему является утрата поринового белка OprD (или снижение его экспрессии) в результате мутаций, происходящих с частотой 10–7, что ведет к нарушению проникновения антибиотика в клетку [20]. При этом МПК увеличивается с 1–2 мкг/мл до 8–32 мкг/мл, что сопровождается клинической неэффективностью препарата. Этот механизм резистентности не затрагивает меропенем, так как его транспорт в клетку может осуществляться и через другие порины.
Резистентность меропенема связана с активацией систем активного выведения антибиотика за пределы микроорганизма (эффлюкс). Данный механизм устойчивости зависит от деятельности протеинов MexA– MexB–OprM, причем MexB представляет собой локализованный на цитоплазматической мембране эффлюксный насос, OprM образует поры, через которые удаляется антибиотик, а MexA связывает их воедино [21] (рис. 2). При этом МПК увеличивается незначительно (с 0,12–0,5 мкг/мл до 2–4 мкг/мл3), а клиническая эффективность меропенема сохраняется при его назначении в суточной дозе 3 г. Лишь сочетание обоих механизмов – активного выведения и утраты порина OprD (что возможно при двух одновременных генных мутациях, вероятность которых крайне низкая – 10–14), приводит к развитию резистентности и неэффективности терапии [22].
В Европейских странах наиболее высокую активность против P. aeruginosa сохраняют меропенем, амикацин и пиперациллин/тазобактам [23] (рис. 3А). В России в ОРИТ наименьший уровень устойчивости синегнойной палочки отмечается к меропенему, амикацину и цефтазидиму, в то время как резистентность к имипенему, ципрофлоксацину, пиперациллину/тазобактаму и особенно гентамицину выше [24] (рис 3Б).
По данным отдельных авторов, до 44% штаммов P. aeruginosa, резистентных к имипенему, сохраняли чувствительность к меропенему [25]. В многоцентровом клиническом исследовании, проведенном в России, 92% изолятов P. aeruginosa от больных с тяжелыми инфекциями в ОРИТ были чувствительны к меропенему [26].
Потребление имипенема коррелирует с ростом резистентности к нему и антисинегнойным цефалоспоринам у P. aeruginosa [27]. Напротив, применение меропенема не ведет к селекции AmpC штаммов P. aeruginosa – гиперпродуцентов хромосомных БЛ, так как препарат подавляет и дерепрессированные штаммы–мутанты [28].
Эффект инокулюма
Инокулюм–эффект заключается в значительном (в 4 раза и выше) увеличении МПК при повышении плотности бактериальной популяции в 100 раз. Это показатель in vitro, который используется для предсказания риска неэффективности терапии в случаях тяжелых инфекций с высокой бактериальной нагрузкой [30]. При абсцессах, менингитах, эндокардитах, нозокомиальных пневмониях концентрация возбудителя в очаге инфекции может достигать 109 КОЕ/мл, что ведет к неэффективности цефалоспоринов, несмотря на чувствительность к ним микроорганизмов in vitro [30–32]. Эффекту инокулюма особенно подвержены антисинегнойные b–лактамы – пиперациллин, пиперациллин/тазобактам, цефтазидим и цефепим [33, 34].
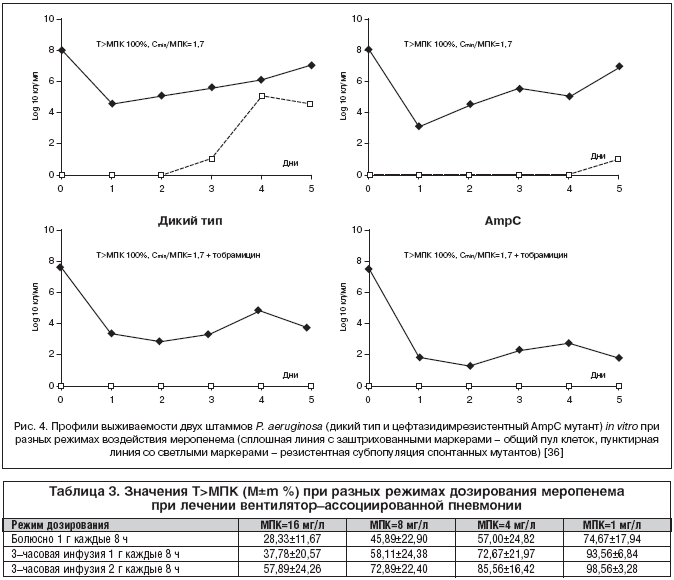
При количестве микробов выше 107–108 КОЕ/мл растет частота спонтанных хромосомных мутаций, ведущих к дерепрессии гена AmpC и гиперпродукции БЛ, гидролизующих пенициллины, цефалоспорины, и не чувствительных к действию ингибиторов. Их селекцию можно подавить путем выбора оптимального режима воздействия меропенема. Методом компьютерного моделирования тяжелой нозокомиальной пневмонии при высокой дозе инокулюма (15 мл 1х108 КОЕ/мл) in vitro показано, что при концентрации антибиотика в плазме (С), соответствующей Сmin/МПК=1,7 (ее можно достичь путем 3–часовой инфузии 500 мг меропенема [35]), в сочетании с тобрамицином подавляется рост P. aeruginosa дикого типа и цефтазидимрезистентного штамма и полностью ингибируется формирование AmpC мутантов на протяжении всего срока наблюдения (5 дней), в то время как в отсутствие аминогликозида к концу 24 ч возобновляется рост бактериальных популяций обоих штаммов, а после двух суток происходит селекция AmpC мутантов дикого типа при той же концентрации меропенема [36] (рис. 4). Благодаря этой стратегии (комбинация меропенема с аминогликозидами) можно подавить образование спонтанных мутантов P. aeruginosa у иммунокомпетентных пациентов при условии, что Т>МПК = 100%, то есть речь идет о постоянной инфузии антибиотика.
Оптимизация режимов
дозирования меропенема
Карбапенемы относятся к зависимым от времени антибиотикам. Стабильный бактерицидный и адекватный клинический эффект при их применении может быть достигнут, если концентрации препарата в крови в 2–4 раза превышают значения МПК в течение 40–50% интервала времени между дозами (%Т>МПК более 40% коррелирует с бактериальным киллингом) [37]. Для меропенема этот период длится 4 ч. Эффективность антибиотика можно повысить путем увеличения дозы, кратности применения (3–4 раза в сутки) и/или продолжительности инфузии [38].
На примере меропенема достаточно хорошо изучено применение b–лактамов в режиме продленной инфузии, когда разовая доза препарата вводится в течение 3–х часов. Этому во многом способствовало применение метода симуляции Monte Carlo, разработанного на основе компьютерного моделирования, позволяющего анализировать вероятность достижения определенных фармакодинамических целей с учетом вышеперечисленных факторов [39]. Исходя из параметра 40%Т>МПК методом Monte Carlo было показано, что при инфузии 500 мг меропенема в течение 30 мин каждые 8 ч достигается выраженный бактерицидный эффект в отношении E. coli и K. pneumoniae, но недостаточный для Acinetobacter baumanii и P. aeruginosa. Удлинение сроков инфузии антибиотика в той же дозе до 3 ч сопровождается заметным повышением его эффективности, сопоставимой с активностью меропенема при болюсном введении в дозе 2 г [40] (рис. 5). Также было показано, что при заданных значениях МПК 16 мкг/мл 3–часовая инфузия 2 г меропенема позволяет достичь показателя 48%Т>МПК, а это свидетельствует о возможности эффективного воздействия на штаммы, считающиеся резистентными к меропенему на основании данных МПК [41]. Полученные результаты были подтверждены в клиническом исследовании у больных с вентилятор–ассоциированной пневмонией (ВАП), где при 3–часовой инфузии 2 г меропенема каждые 8 ч создавались концентрации в плазме, превышающие МПК 16 мкг/мл в течение почти 60% 8–часового интервала [42] (табл. 3). В другом исследовании при лечении ВАП меропенемом в течение 14 дней (1 г каждые 6 ч) клиническая эффективность в режиме продленной инфузии (15 больных) была выше в сравнении с болюсным введением (18 больных) препарата (93,3% против 63,3%; р=0,038), а атрибутивная летальность была ниже (соответственно, 6,7% и 23,3%; р=0,236) [43]. Режим дозирования меропенема в виде продленных инфузий, наряду с фармакодинамическими преимуществами (достижение более высоких концентраций препарата в очаге воспаления, преодоление резистентности возбудителей) имеет фармакоэкономические преимущества, обеспечивающие снижение курсовой стоимости лечения [44,45].
Карбапенемы как препараты выбора при эмпирической терапии тяжелых инфекций
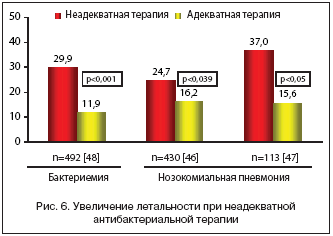
Частой ошибкой в лечении вновь возникающих инфекций у госпитализированных больных является недооценка высокой вероятности наличия резистентных возбудителей и использование на начальном этапе эмпирической терапии «простых» антибиотиков, резервируя мощные препараты широкого спектра для пациентов, состояние которых прогрессивно ухудшается и/или у которых уже высеяны резистентные микроорганизмы. Такой подход может быть приемлем при нетяжелых и средней тяжести внебольничных инфекциях, но, как свидетельствуют многочисленные исследования, при нозокомиальных инфекциях кровотока и ВАП неадекватная стартовая антимикробная терапия сопровождается достоверным увеличением летальности, а последующая ее коррекция (после получения результатов микробиологического исследования) не улучшает исходов заболевания [46–48] (рис. 6). Kollef M.H. и соавт. [49] показали, что при нозокомиальных инфекциях терапия оказывается неадекватной в 2 раза чаще, чем при внебольничных инфекциях (34% против 17%), а предшествующее применение антибиотиков, являясь фактором риска высокой резистентности возбудителя, еще в 1,5 раза повышает вероятность проведения неадекватной терапии (45%).
Накоплено много данных о том, что раннее применение карбапенемов в режиме деэскалационной эмпирической терапии существенно повышает эффективность лечения. Согласно результатам российского исследования АСЭТ [50] монотерапия тяжелых нозокомиальных инфекций (пневмонии, распространенного перитонита, инфицированного панкреонекроза) меропенемом по клинической и бактериологической эффективности превосходит стандартную терапию b–лактамами и фторхинолонами в комбинации с аминогликозидами и/или метронидазолом и/или ванкомицином.
Отечественными авторами [51] проведен сравнительный анализ различных схем антибактериальной терапии при нозокомиальных перитонитах и абдоминальном сепсисе. Наиболее высокая эффективность была достигнута при монотерапии карбапенемом, в два раза ниже была эффективность при использовании комбинации цефепима и метронидазола и самая низкая отмечалась при монотерапии защищенным пенициллином. Назначение карбапенемов при распространенном перитоните и инфицированном панкреонекрозе, требующем обязательного оперативного лечения, является наиболее эффективным режимом антибиотикотерапии, а средняя продолжительность монотерапии может достигать 3 нед [52]. Показано достоверное снижение летальности в 3 раза при панкреатогенном сепсисе, леченном карбапенемами в сравнении с другими антимикробными препаратами [49]. Считается, что тяжесть состояния больного по шкале АРАСНЕ II свыше 13 баллов и по шкале Ranson более 4 баллов является абсолютным показанием к назначению карбапенемов при панкреонекрозе независимо от наличия результатов микробиологического исследования, подтверждающих факт инфицирования поджелудочной железы и забрюшинной клетчатки [53]. В проспективном рандомизированном исследовании [54] сравнивали эффективность меропенема с имипенемом в профилактике септических осложнении при тяжелой форме панкреонекроза (в каждой группе по 88 пациентов). Частота возникновения панкреатогенных и внепанкреатических инфекций была практически одинаковой (11,4% против 13,6% и 21,6% против 23,9% соответственно), не было отличий по срокам госпитализации и клиническим исходам.
При сравнении меропенема и имипенема по результатам мета–анализа 27 разных источников не выявлены различия в смертности пациентов при лечении тяжелых внебольничных и нозокомиальных инфекций нижних отделов дыхательного тракта, органов брюшной полости и малого таза, а также сепсиса (ОШ 0,98; 95% ДИ 0,71–1,35). Однако у меропенема отмечена более высокая клиническая (ОШ 1,04; 95% ДИ 1,01–1,06) и бактериологическая (ОШ 1,05; 95% ДИ 1,01–1,08) эффективность и наблюдалось меньше осложнений, выявленных с помощью лабораторных тестов (тромбоцитоз, повышение уровня печеночных ферментов) либо по клинической симптоматике [55]. Меропенем безопаснее имипенема при лечении больных с сопутствующими заболеваниями центральной нервной системы и нарушенной функцией почек и может использоваться для терапии бактериальных менингитов.
Заключение
Массовое эмпирическое назначение карбапенемов связано со значительными финансовыми затратами и способствует селекции полирезистентных штаммов грамотрицательных бактерий, поэтому их следует применять строго по показаниям.
С позиции доказательной медицины (мета–анализ и данные мультицентровых исследований) карбапенемы наиболее надежны в качестве средств стартовой эмпирической терапии тяжелых госпитальных инфекций. Они являются препаратами первого ряда при инфекциях у больных в критическом состоянии (по шкале АРАСНЕ II более 13 баллов), при поздней (более 5 суток) ВАП, инфицированном панкреонекрозе, послеоперационном менингите (меропенем, но не имипенем!), при инфекциях у больных с нейтропенией, при гнойных процессах в легких на фоне иммунодефицита. У этих пациентов можно ожидать снижения смертности при проведении деэскалационной терапии.
В качестве препаратов второго ряда карбапенемы применяются при неэффективности терапии первоначально выбранными антибиотиками, что явилось причиной перевода пациента в ОРИТ из другого отделения больницы, и при анамнестических указаниях на недавнюю терапию несколькими антибиотиками. Длительность лечения обычно составляет от 3–5 до 14 суток и определяется конкретной клинической ситуацией.
Целенаправленная терапия антисинегнойными карбапенемами проводится при документированных инфекциях, вызванных продуцентами БЛРС, где выбор препаратов за редким исключением ограничен меропенемом и имипенемом. При синегнойной инфекции меропенем превосходит имипенем по степени активности, а для преодоления приобретенной резистентности P. aeruginosa перспективным является применение антибиотика в режиме продленной инфузии.




Литература
1. Pfaller M.A., Jones R.N. A review of the in vitro activity of meropenem and comparative antimicrobial agents tested against 30,254 aerobic and anaerobic pathogens isolated world wide. Diagn Microbiol Infect Dis 1997; 28:157–163.
2. Fish D.N., Singletary T.J. Meropenem: a new carbapenem antibiotic. Pharmacotherapy 1997; 17(4):644–669.
3. Blumer J.I. Meropenem: evaluation of a new generation carbapenem. Intern J Antimicrob Agent 1997: 8(2):73–92.
4. Jones R.N. In vitro evaluation of ertapenem (MK–0826), a long acting carbapenem, tested against selected resistant strains 2001; 13:363–376.
5. Mouton J.W., Touzw D.J., Horrevorts A.M., Vinks A.A. Comparative pharmacokinetics of the carbapenems: clinical implications. Clin Pharmacokinet 2000; 39:185–201.
6. Bush K., Jacoby G.A., Medeiros A.A. A functional classification scheme for beta–lactamases and its correlation with molecular structure. Antimicrob Agents Chemother 1995; 39: 1211–1233.
7. Andes D., Craig W.A. Impact of extended spectrum beta–lactamase (ESBL) production on the activity of cefepime in a murine–thigh infection model. Abstracts of the 41th Interscience Conference on Antimicrobial Agents and Chemotherapy, Desember 2001.
8. Kollef M. Appropriatr empirical antibacterial therapy for nosocomial infections. Drugs 2003 ; 63(2): 2157–2168.
9. McGowan J.E., Tenover F.C. Control of antimicrobial resistance in the health care system. Infect Dis Clin North Am 1997; 11: 297–311.
10. Jones R.N., Pfaller M.A., and the MYSTIC Study Group. Antimicrobial activity of selected agents against strains of Escherichia coli, Klebsiella spp. And Proteus mirabilis with resistance phenotypes consistent with an extended spectrum beta–lactamase: report from the MYSTIC programme in Europe (1997–2000). Clin Microbiol Infect 2001; 7(Suppl 1):P438.
11. Сидоренко С.В. Антибактериальная терапия. Практическое руководство. Под ред. Л.С.Страчунского, Ю.Б.Белоусова, С.Н.Козлова. М., 2000; 1–6.
12. Jacoby G.A. Extended–spectrum beta–lactamases and other enzymes providing resistance to oxyimino–beta–lactams. Infect Dis Clin North Amer 1997; 11:875–87.
13. Patterson J.E., Recb M., Jorgensen J.H. Extended–spectrum–beta–lactamases: dilemmas in detection and therapy. Antimicrob Infect Dis Newsletter 1998; 16:57–61.
14. Эйдельштейн М.В., Страчунский Л.С. Динамика распространенности и чувствительности БЛРС–продуцирующих штаммов энтеробактерий к различным антимикробным препаратам в ОРИТ России. Клин Микробиол Антимикроб Химиотер. 2005; 7(4):323–336.
15. NCCLS 2000. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically. Approved standard M7–A5, 5th ed. National Committee for Clinical Laboratory Standards, Wayne, Pa.
16. Jones R.N. Resistance patterns among nosocomial pathogens: trends over the past few years. Chest 2001; 119: 397S–404S.
17. Quale G., Landman D., Saurina G. et al. Molecular epidemiology of a sitywide outbreak of extended–spectrum beta–lactamase producing Klebsiella pneumoniae infection. Clin Infect Dis 2002;35:834–841.
18. Shah P.M. Parenteral carbapenems. Clin Microbiol Infect 2008; 14(Suppl 1): 175–180.
19. Pfaller M.A., Jones R.N., and the MYSTIC Study Group. Antimicrobial susceptibility of inducible AmpC beta–lactamase produsing Gram–negative bacilli from the European Meropenem Yearly Susceptibility Test Information Collection (MYSTIC) programme 1997–2000. Clin Microbiol Infect 2001; 7(Suppl 1):P439.
20. Edwards J. Meropenem: a microbiological overview. J Antimicrob Chemother 1995; 36(Suppl A): 1–17.
21. Livermore D.M. Of Pseudomonas, porins, pumps and carbapenems. J Antimicrob Chemother 2001; 47:247–250.
22. Livermore D.M. Bacterial resistance: origins, epidemiology and impact. Clin Infect Dis 2003; 36(Suppl 1); S11–S23.
23. Turner P.J. Trends in antimicrobial susceptibilities among bacterial pathogens isolated from patients hospitalized in European medical centers: 6–year report of the MYSTIC surveillance study (1997–2002). Diagn Microbiol Infect Dis 2005; 51: 281–289.
24. Страчунский Л.С., Решедько Г.К., Стецюк О.У. и др. Сравнительная активностьантисинегнойных антибиотиков в отношении нозокомиальных штаммов P.aeruginosa, выделенных в отделениях реанимации и интенсивной терапии. Клин Микробиол Антимикроб Химиотер 2003; 5(1): 35–46.
25. Iaconis J.P., Pitkin D.H., Skeikb W., et al. Comparison of antibacterial activities of meropenem and six other antimicrobials agents Pseudomonas aeruginosa isolates from North American studies and clinical trials. Clin Infect Dis 1997; 24(Suppl 2):S191–7.
26. Яковлев С.В., Яковлев В.П., Деревянко И.И. и др. Многоцентровое открытое рандомизированное исследование меропенема в сравнении с комбинацией цефтазидима и амикацина при тяжелых госпитальных инфекциях. Антибиотики и химиотерапия. 1998; 43(1):15–23.
27. Lepper P.M., Grusa E., Reichl H., et al. Consumption of imipenem correlates with beta–lactam resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother 2002; 46: 2920–2925.
28. Сидоренко С.В., Резван С.П., Стерехова Г.А., Грудинина С.А. Госпитальные инфекции, вызванные Pseudomonas aeruginosa. Распространенность и клиническое значение антибиотикорезистентности. Антибиотики и химиотерапия. 1999; 44(3):25–34.
29. Решедько Г.К., Рябкова Е.Л., Фаращук А.Н., исследовательская группа РОСНЕТ. Неферментирующие грамотрицательные возбудители нозокомиальных инфекций в ОРИТ России: проблемы антибиотикорезистентности. Клин Микробиол Антимикроб Химиотер. 2006; 8(3):243–259.
30. Queenan A.M., Foleno B., Gownley C., et al. Effects of inoculum and beta–lactamase activity in AmpC– and extended–spectrum beta–lactamase (ESBL)–producing Escherichia coli and Klebsiella pneumoniae clinical isolates tested by using NCCLS ESBL methodology. J Clin Microbiol 2004; 42: 269–275.
31. Burgess D.S., Hall R.G. In vitro killing of parenteral beta–lactams agains standart and high inocula of extended–spectrum beta–lactamase and non–ESBL producing Klebsiella pneumoniae. Diagn Microbiol Infect Dis 2004;49:41–46.
32. Kang C.L., Pai H., Kin S.H., et al. Cefepime and the inoculum effect in tests with Klebsiella pneumoniae produsing plasmid–mediated AmpC–type beta–lactamase. J Antimicrob Chemother 2004; 54:1130–1133.
33. Tam V.H., Schilling A.N., Melnick D.A., Coyle E.A. Comparison of beta–lactams in counter selecting resistance of Pseudomonas aeruginosa. Diagn Microbiol Infect Dis 2005; 52:145–151.
34. Thomson K.S., Moland E.S. Cefepime, piperacillin–tazobactam, and the inoculum effect in tests with extended–spectrum beta–lactamase–roducing Enterobacteriaceae. Antimicrob Agents Chemother 2001; 45: 3548–3554.
35. Danekar P.K., Maglio D., Sutherland C.A., et al. Pharmacokinetics of meropenem 0,5 and 2 g every 8 hours as a 3–hour infusion. Pharmacother 2003; 23:988–991.
36. Tam V.H., Schilling A.N., Neshat S., et al. Optimization of meropenem minimum concentration/MIC ratio to suppress in vitro resistance of Pseudomonas aeruginosa. Antimicrob Agents Chemother 2005; 49:4920–4927.
37. Drusano G.L. Pharmacokinetics of meropenem. Antiinfect Drugs Chemother 1996; 14(1):48.
38. Mouton J., van den Anker J. Meropenem clinical pharmacokinetics. Clin Pharmacokinet 1995; 28:275–286.
39. Jumbe N., Louie A., Leafy R., et al. Application of a mathematical model to prevent in vivo amplification of antibiotic–resistant bacterial population during therapy. J Clin Invest 2003; 112: 275–285.
40. Drusano G.L. Carbapenem monotherapy, novel strategies to minimize ICU resistance. 41st ICAAC 2001 December 16. Special Report 2002.
41. Drusano G.L. Prevention of resistance: a goal for dose selection for antimicrobial agents. Clin Infect Dis 2003; 36(Suppl 1):S42–S50.
42. Jaruratanasirikul S., Sriwiriyajan S., Punyo J. Comparison of the pharmacodynamics of meropenem in patients with ventilator–associated pneumonia following administration by 3–hour infusion or bolus injection. Antimicrob Agents Chemother 2005; 49:1337–1339.
43. Lorente L., Huidobro S., Martin M., Mora M. Meropenem administration by intermittent infusion versus continuous infusion for the treatment of nosocomial pneumonia. Critical Care 2005; 9(Suppl 1):P38.
44. Kuri J., Maglio D., Nightingale C., Nicolau D. Economic benefits of a meropenem dosage strategy based on pharmacodynamic concepts. Am J Health Syst Pharm 2003; 60:565–568.
45. Kotapati S., Nicolau D., Nightingale C., et al. Clinical and economic benefits of a meropenem dosage strategy based on pharmacodynamic concepts in a large teaching hospital. Am J Health Syst Pharm 2004; 61:1264–1270.
46. Alvarez–Lerma F. Modification of empiric antibiotic treatment in patients with pneumonia acquired in the intensive care unit: ICU–Acquired Pneumonia Study Group. Intensive Care Med 1996;22:387–394.
47. Rello J., Sa–Borges M., Correa H., et al. The value of routine microbial investigation in ventilator–associated pneumonia. Am J Respir Crit Care Med. 1997;156:196–200
48. Ibrahim E.H., Sherman G., Ward S., et al. The Influence of Inadequate Antimicrobial Treatment of Bloodstream Infections on Patient Outcomes in the ICU Setting Chest 2000;118:146–155.
49. Kollef M.H., Sherman G., Ward S., Fraser V.J. Inadequate antimicrobial treatment of infections: a risk factor for hospital mortality among critically ill patients. Chest 1999; 115:462–474.
50. Яковлев С.В., Белобородов В.Б., Сидоренко С.В. и др. Анализ адекватности стартовых эмпирических Режимов антибактериальной терапии при тяжелых нозокомиальных инфекциях (исследование АСЭТ). Клин Фармакол Тер 2006; 15:14–21.
51. Савельев В.С., Гельфанд Б.Р. (ред). Антибактериальная терапия абдоминальной хирургической инфекции. М. 2003; Изд.3: 185 с.
52. Tellado J.M., Christou N.V. Intra–abdominal infections. – Madrid. “Harcourt” 2000; 219–246.
53. Гельфанд Б.Р., Бурневич С.З., Гельфанд Е.Б. и др. Эффективность пефлоксацина (абактала) в комплексном лечении больных с панкреонекрозом. Антибиотики и химиотерапия 2001; 46(5): 24–27.
54. Manes G., Rabitti P.G., Menchise A., et al. Prophylaxis with meropenem of septic complications in acute pancreatitis: a randomized, controlled trial versus imipenem. Pancreas 2003; 27:79–83.
55. Edwards S.J., Emmas C.E., Campbell H.E. Systematic review comparing meropenem with imipenem plus cilastatin in the treatment of severe infections. Cur Med Research Opinion 2005; 21:785–794.
rmj.ru
|









 Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог..
Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог.. включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн..
включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн.. Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп..
Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп.. Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас..
Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас.. Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..
Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..






 Новости
Новости 