Применение пробиотического продукта в диетотерапии детей с измененной аллергической реактивностью
Д. В. Усенко, кандидат медицинских наук
А. В. Горелов, доктор медицинских наук, профессор
С. В. Шабалина, доктор медицинских наук, профессор
НИИ эпидемиологии, Москва
Одной из актуальных проблем здравоохранения является значительный рост числа
аллергических заболеваний. Среди них к числу наиболее часто встречающихся в
детском возрасте относится атопический дерматит (от 7 до 81 на 1000 человек
детского населения) [1, 2]. В последние годы в качестве одного из перспективных
направлений повышения эффективности профилактики и лечения аллергических
заболеваний рассматривается сохранение баланса и коррекция нарушений
микробиоценоза желудочно-кишечного тракта (ЖКТ) с использованием пробиотиков.
Предпосылкой для этого служат данные о потенциальных противоаллергических
эффектах гастроинтестинальной микрофлоры: участие в регуляции иммунного ответа
Th-1–Th-2, выработке трансформирующего фактора роста (TGF) β, играющего важную
роль в подавлении Th-2-индуцированной гиперреактивности и формировании пищевой
толерантности, а также повышение уровня иммуноглобулина (Ig) A, являющегося
одним из важных компонентов иммунитета слизистых оболочек [3]. На связь пищевой
аллергии и нарушений интестинальной флоры еще в начале 1980-х гг. указали И. Б.
Куваева и К. С. Ладодо [4]. За счет протеолиза эндотоксинов, аллергенов и
антигенов, поступающих c пищей, антагонизма в отношении условно-патогенной
микрофлоры, продуцирующей в кишечнике токсические метаболиты, микрофлора
контролирует попадание в кровоток субстанций, служащих пусковыми агентами при
пищевой непереносимости по типу атопической реакции. Это также касается
всасывания в кишечнике частично переваренных белков, в том числе способствующих
развитию пищевой аллергии и сопутствующих ей кожных патологических проявлений.
В. Д. Дорофейчук указывает на наличие либерации гистамина в стенке кишки у детей
«атопиков» под действием бактериальных агентов золотистого стафилококка и
гемолизирующей кишечной палочки. Известно, что некоторые бактерии
условно-патогенной группы способствуют усилению проницаемости кишечного барьера
для макромолекул, а активное вегетирование их в просвете кишки приводит к
развитию бактериальной сенсибилизации [5, 6].
В настоящее время установлено несколько механизмов, посредством которых
пробиотики изменяют аллергическое воспаление:
- изменение иммуногенности аллергенов;
- снижение секреции воспалительных медиаторов в кишечнике (снижение уровня
TGF-a в кале);
- нормализация проницаемости кишечной стенки;
- изменение общей иммунологической реактивности (снижение уровня
эозинофильного катионного белка, изменение продукции интерлейкина (IL)-2,
IL-4, IL-10 и α-интерферона).
В качестве примера клинической эффективности пробиотиков можно привести
результаты исследования, проведенного в 2000 г. E. Isolauri и соавторами.
Молочную смесь, содержащую культуру пробиотика Bifidobacterium lactis Bb12 и
Lactobacillus GG, назначали 27 детям, страдающим атопической экземой. Через 2
мес после начала приема пробиотического продукта отмечалось выраженное улучшение
состояния кожи детей, снижение индекса SCORAD, на фоне значительного уменьшения
уровня эозинофильного протеина Х в моче [3].
В двойном слепом плацебо-контролируемом исследовании, в котором приняли
участие 62 человека — матери с детьми с высоким риском развития аллергических
заболеваний (S. Rautava и соавт., 2002), также назначение пробиотиков
Lactobacillus GG и Bifidobacterium lactis Bb12 беременным и кормящим матерям
значительно снижало риск развития у ребенка аллергического заболевания в течение
первых 2 лет жизни. При этом у матерей, получавших пробиотики во время
беременности и лактации, отмечалось увеличение уровня противовоспалительного
цитокина TGF-β в молоке [7].
В качестве одной из перспективных форм профилактики нарушений микрофлоры ЖКТ
в последние годы рассматриваются пробиотические продукты. Основой для их
производства чаще всего являются традиционные йогуртные культуры — Lactobacillus
bulgaricus и Streptococcus thermophylus. Благодаря включению в их состав
различных пробиотических микроорганизмов — лактобактерий и бифидобактерий,
данные продукты приобретают как общеукрепляющие, так и лечебные свойства. В
большинстве клинических исследований современных пробиотических продуктов в
качестве плацебо-контроля используется продукт, созданный на основе аналогичной
закваски, но не содержащий пробиотических микроорганизмов. Данный подход
позволяет нивелировать возможное влияние заквасочной культуры молочнокислых
микроорганизмов на результаты эксперимента.
Целью настоящего исследования, проведенного под эгидой Института Данон
(Россия) (2004), явилась оценка переносимости и клиническая эффективность
пробиотического штамма Lactobacillus casei DN-114001 в составе кисломолочного
продукта, в комплексной терапии атопического дерматита у детей с острой диареей.
Под наблюдением находились 25 детей в возрасте 3–8 лет, больных атопическим
дерматитом, с острой кишечной инфекцией (ОКИ). Все больные были разделены на две
группы — основная (15 детей) и группа сравнения (10 детей). Дети основной группы
в комплексной терапии, помимо пероральной регидратации, энтеросорбентов,
получали кисломолочный продукт на основе йогуртовой закваски (Streptococcus
thermophilus и Lactobacillus bulgaricus), обогащенный пробиотическим штаммом L.
casei DN-114001 (L. casei Defensis) в количестве 108 КОЕ/мл. Дети группы
сравнения в комплексной терапии получали традиционный кисломолочный продукт на
основе йогуртовой закваски, не содержащий пробиотиков. Длительность приема
изучаемых продуктов составила 21 день, в среднем по 100 мл 1 раз в день, во
время завтрака.
ОКИ у детей протекала в форме гастроэнтерита (у 15 больных), энтерита (у 7) и
энтероколита (у 3). Преобладали легкие формы заболевания (у 15 детей).
Среднетяжелые формы ОКИ были отмечены у 10 детей, у 2 из них развился токсикоз с
эксикозом I степени.
Атопический дерматит имел преимущественно легкое течение (у 86,7% детей
основной группы и у 70% группы сравнения) и протекал в двух клинических формах:
простой эритематозно-сквамозной (46,7%) и эритематозно-сквамозной с лихенизацией
(46,7%). У 15 детей в остром периоде ОКИ отмечалось обострение кожных проявлений
атопического дерматита, не связанное с погрешностями в диете, что согласуется с
полученными ранее данными о неблагоприятном влиянии острых заболеваний ЖКТ на
течение основного заболевания у детей с атопией [3].
На фоне комплексной терапии, в составе которой использовался кисломолочный
пробиотический продукт, было отмечено уменьшение клинических проявлений
заболевания у детей основной группы, в частности папулезных высыпаний и кожного
зуда, особенно при легком течении, а в группе сравнения — лишь незначительное
сокращение числа высыпаний. Статистически достоверно снизился индекс SCORAD
(табл. 1).

Таблица 1. Оценка тяжести атопического дерматита (SCORAD)
Использование пробиотического продукта у детей с атопическим дерматитом также
оказывало положительное влияние и на клинические проявления острой диареи. При
этом было отмечено сокращение продолжительности диарейного синдрома (4,8 ± 0,42
сут в основной группе и 6,2 ± ± 0,42 сут в группе сравнения) (р < 0,05) и в
меньшей степени — симптомов интоксикации, боли в животе, анорексии.
При оценке состояния микрофлоры кишечника у всех 20 детей в острый период
заболевания регистрировались выраженные дисбиотические изменения (I степени — у
6 детей, II степени — у 8, III степени — у 6); при этом, в первую очередь
выявляли сниженное содержание лактобактерий (< 106) — у 8 больных,
бифидобактерий — у 7, полноценных в ферментативном отношении E. coli — у 5. У 7
пациентов выросло число бактерий рода Clostridium, у 8 детей — Staphylococcus, у
1/3 обследованных удалось выявить повышенное количество различных
условно-патогенных энтеробактерий, у 4 больных — грибы рода Candida.
На фоне терапии с использованием продукта, обогащенного L. casei DN-114001,
нормализация дисбиотических нарушений была выявлена у 7 детей основной группы.
После 2 нед употребления данного продукта ни у одного ребенка не
диагностировался дисбактериоз III степени.
В то же время в группе сравнения не были получены значимые положительные
изменения в структуре микрофлоры: состояние эубиоза к концу лечения было
отмечено только у 1 больного.
При оценке состояния местного гуморального иммунитета ЖКТ было установлено,
что на фоне употребления кисломолочного продукта, содержащего L. Casei, в остром
периоде кишечной инфекции происходит статистически значимое нарастание уровня
IgA (с 53,42 ± 5,18 до 79,3 ± 11,3 мкг/мл) и секреторного IgA (с 185,1 ± 32,65
до 202,8 ± 35,2 мкг/мл) в слюне. В группе сравнения существенных изменений
уровня IgA не отмечалось (с 43,07 ± 7,41 до 51,1 ± 10,4 мкг/мл), а содержание
секреторного IgA к концу лечения существенно снижалось (с 230,6 ± 42,2 до 203,4
± 36,4 мкг/мл).
Не менее важной задачей исследования явилась оценка безопасности
использования пробиотического кисломолочного продукта на основании анализа
динамики аллергологических параметров.
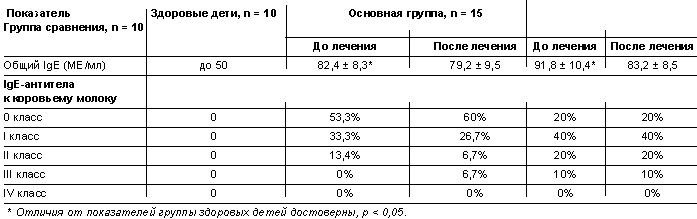
Уровень общего IgE и IgE-антител к аллергену из цельного
коровьего молока у детей с атопическим дерматитом, употребляющих кисломолочные
продукты
Несмотря на то что у испытуемых часто определялся повышенный уровень
IgE-антител к коровьему молоку (при отсутствии четких данных о взаимосвязи
обострения атопического дерматита с употреблением коровьего молока и
кисломолочных продуктов) (64%), включение исследуемых продуктов в рацион питания
детей с атопией не вызвало нарастания уровня сенсибилизации. Только у 1 ребенка,
получавшего традиционный кисломолочный продукт, было отмечено усиление
сенсибилизации со II до III степени. Практически не менялись также уровни IgG и
IgG4-антител к белкам коровьего молока — они оставались стабильно выше
аналогичных показателей у здоровых детей.
Таким образом, сравнительное клинико-лабораторное исследование демонстрирует
безопасность введения в рацион питания детей с атопическим дерматитом
кисломолочных продуктов на основе йогуртовой закваски, в том числе обогащенных
пробиотическими микроорганизмами. Полученные данные о более выраженной регрессии
клинических проявлений заболевания и сокращении длительности симптомов ОКИ, а
также улучшении состава микрофлоры кишечника в основной группе обосновывают
целесообразность использования пробиотического продукта, содержащего L. casei
DN-114001, в питании этих больных. Достоверное нарастание концентрации IgA и
секреторного IgA в слюне пациентов основной группы свидетельствует об улучшении
протекторных свойств слизистой оболочки ЖКТ на фоне употребления пробиотического
продукта с L. casei DN-114001.
Литература
- Ильина Н. И. Аллергопатология в различных регионах России по результатам
клинико-эпидемиологических исследований: автореф. дис. ... д-ра мед. наук. М.,
1996. 24 с.
- Атопический дерматит у детей: диагностика, лечение и профилактика:
научно-практическая программа. М., 2000. С. 76.
- Isolauri E., Arvola T., Sutas Y. et al. Probiotocs in the management of
atopic aczema //Clin. Exp. Allergy. 2000; 30: 1605–1610.
- Куваева И. Б., Ладодо К. С. Микроэкологические и иммунные нарушения у
детей. М.: Медицина, 1991. 432 с.
- Gibson G. R., Roberfroid M. B. dietary modulation of the human colonic
microbiota: introducing the concept of probiotics//J. Nutr. 1995; 125:
1401–1412.
- Макарова С. Г. Диетическая коррекция дисбактериоза кишечника при пищевой
аллергии у детей раннего возраста: автореф. дис. ... канд. мед. наук. М.,
1992. 24 с.
- Rautava S., Kalliomaki M., Isolauri E. Probiotics during pregnancy and
breast-feeding might confer immunomodulatory protection against atopic disease
in the infant//J. Allergy. Clin. Immunol. 2002; 109(1): 119–121.
Статья опубликована в журнале
www.medicusamicus.com
| 








 Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог..
Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог.. включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн..
включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн.. Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп..
Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп.. Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас..
Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас.. Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..
Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..


 Новости
Новости 