Перспективное лекарство против болезни Альцгеймера — компонент клеточной стенки бактерии сальмонеллы
Болезнь Альцгеймера связана с отложением агрегатов белка бета-амилоида в головном мозге человека. Одно из возможных направлений борьбы с этими отложениями — поиск веществ, стимулирующих фагоцитарную активность клеток микроглии — главного компонента иммунной защиты головного и спинного мозга, — то есть их способность поглощать чужеродные частицы, в том числе и амилоидный белок. Группа ученых из Канады, Бельгии и США предложила в качестве такого вещества монофосфорил-липид A (MPL) — модифицированный липополисахарид клеточной стенки бактерии Salmonella minnesota. Раствор MPL уменьшает количество и площадь амилоидных бляшек в мозгу трансгенных мышей и улучшает их способность к запоминанию.

Более 35 миллионов человек по всему миру живут с диагнозом «болезнь Альцгеймера». И хотя основным фактором риска является преклонный возраст, эту болезнь также диагностируют и у людей 30–40 лет. Из-за прогрессирующего ухудшения памяти и развивающегося слабоумия такие больные прикованы к госпиталям и домам престарелых, проживая остаток жизни без надежды на выздоровление.
Патогенез болезни Альцгеймера связан с накоплением нерастворимых бляшек ?-амилоидных пептидов (см. Beta amyloid, amyloid ?, A?) в тканях головного мозга, которое возникает из-за спонтанного нарушения баланса превращений предшественника бета-амилоида — белка, встроенного в клеточные мембраны нейронов.
Белок — предшественник амилоида (Amyloid precursor protein, APP) обнаружен во многих тканях организма, где он является нормальным трансмембранным белком, однако его функции до сих пор окончательно не установлены. В зависимости от доступности специфических участков молекулы белка для своеобразных белков-«ножниц» — ферментов секретаз (см. Secretase), APP может вступать на один из двух возможных путей преобразования — амилоидогенный или неамилоидогенный (см. обзорную статью Querfurth & LaFerla, 2010. Alzheimer's Disease). Оба пути характерны для нормальных клеток (рис. 1). Нас интересует амилоидогенное преобразование белка, поскольку неамилоидогенный путь, связанный с расщеплением белка ферментом ?-секретазой, не может привести к образованию опасного для клеток амилоидного белка A?42, так как уже на первой стадии происходит расщепление внутри последовательности A?.
Амилоидогенное преобразование предшественника начинается с отщепления его внеклеточного фрагмента под действием фермента ?-секретазы. Оставшийся фрагмент подвергается дальнейшему расщеплению ?-секретазой с образованием ?-амилоида. ?-амилоидные пептиды, состоящие из 36–43 аминокислот, являются естественными продуктами метаболизма; при этом в норме мономерных пептидов длиной 40 аминокислот образуется значительно больше, чем склонных к агрегации повреждающих более длинных пептидов (обычно их размер составляет 42 аминокислоты: A?42). Нарушение баланса между двумя путями преобразования APP, образованием, разрушением и агрегацией (слипанием) пептидов, приводит к накоплению A?42, что может стать пусковым фактором в развитии болезни.
Ученые из научно-исследовательского клинического центра Университета Лаваля (Квебек, Канада), совместно с коллегами из Бельгии и США предположили, что перспективным направлением поиска возможного лекарства против болезни Альцгеймера являются вещества, стимулирующие фагоцитарную активность клеток микроглии — главного компонента активной иммунной защиты головного и спинного мозга.
Характерная для многих типов иммунных клеток фагоцитарная активность, то есть способность клетки захватывать и перерабатывать твердые частицы (в том числе бактерии, вирусы, агрегированные белки), — это первая линия защиты от многих заболеваний. Ее можно стимулировать при помощи различных компонентов вирусов и бактерий. В клетках микроглии, как и в других клетках иммунной системы, есть специальные сенсоры молекул, характерных для патогенов, — так называемые Толл-подобные рецепторы (Toll-like receptors, TLRs). Когда в организм попадает патоген, клетки иммунной системы мобилизуются на защиту организма за счет активации этих рецепторов. Увеличение фагоцитарной активности микроглии важно также для защиты от агрегатов белка-амилоида, образующихся при болезни Альцгеймера.
К таким специфическим для патогенов молекул, по которым организм может распознать инфекцию и мобилизовать иммунную систему, относится липополисахарид (Lipopolysaccharide) — компонент клеточной стенки грамотрицательных бактерий (см. также: Bacterial cell walls). Проблема состоит в том, что липополисахарид патогенных бактерий может быть токсичным для организма человека. Поэтому авторы статьи решили использовать для стимуляции клеток микроглии безвредный химически модифицированный липополисахарид клеточной стенки бактерии Salmonella minnesota — монофосфорил-липида A (Monophosphoryl lipid A, MPL) (рис. 2).
В качестве модели, позволяющей изучать механизм отложения A?, в экспериментах in vivo использовалась линия трансгенных мышей с химерным белком (Chimeric protein) — предшественником амилоида. К 9 месяцам жизни в мозгу таких животных обнаруживается большое число бляшек ?-амилоида, напоминающих те, что образуются в мозгу пациентов, страдающих болезнью Альцгеймера. Способность к запоминанию у таких мышей с возрастом снижается и ухудшается по сравнению с мышами, у которых в мозгу нет бляшек.
Результаты, полученные после инкубации клеток микроглии этой линии мышей с раствором MPL, подтвердили стимулирующее действие монофосфорил-липида A на фагоцитарную активность (рис. 3).

Для оценки эффективности MPL in vivo, трансгенным мышам из трех экспериментальных групп в течение длительного времени вводили растворы исследуемых веществ. Контрольной группе делали инъекции биологически нейтрального натрий-фосфатного буфера (Phosphate buffered saline, PBS), экспериментальным группам вводили растворы MPL или немодифицированного липополисахарида. Оказалось, что по сравнению с контрольной группой, которой вводили раствор натрий-фосфатного буфера, количество и общая площадь ?-амилоидных бляшек в коре головного мозга мышей, которым был введен раствор MPL, значимо снижены (рис. 4). Кроме того, в отличие от исходного крайне токсичного липополисахарида сальмонеллы, инъекция MPL не приводила к развитию воспаления, опасного для жизни.

Результаты поведенческих тестов также показали значительные улучшения у животных показателей обучаемости и памяти по сравнению с контролем. Для определения способности мышей к запоминанию использовали водный T-образный лабиринт. В таком лабиринте животное должно выбрать между двумя рукавами, в одном из которых размещена невидимая платформа, на которую животное может залезть (мышь, попав в воду, стремится оказаться снова на суше). Авторы сначала «научили» мышь систематически выбирать левый рукав, в котором всё время находилась платформа. После этого оценивалось, сколько нужно попыток для того, чтобы мышь начала выбирать правый рукав, в который переместили платформу. Критерием обучения считали 5 правильных выборов подряд. Оказалось, что для трансгенных мышей, которых использовали в работе, нужно в среднем около 17 попыток, чтобы запомнить, что платформа находится в правом рукаве. При этом мышам, которым вводили MPL, было достаточно 10 попыток.
Результаты проведенной работы представляют монофосфорил-липид A как многообещающий препарат для безопасного и эффективного лечения болезни Альцгеймера.
Источник: Jean-Philippe Michauda, Maxime Hall?, Antoine Lampron, Peter Th?riault, Paul Pr?fontaine, Mohammed Filali, Pascale Tribout-Jover, Anne-Marie Lanteigne, Rachel Jodoin, Christopher Cluff, Vincent Brichard, R?mi Palmantier, Anthony Pilorget, Daniel Larocque, and Serge Rivest. Toll-like receptor 4 stimulation with the detoxified ligand monophosphoryl lipid A improves Alzheimer's disease-related pathology. // Proc Natl Acad Sci USA. January 29, 2013. V. 110. No. 5. P. 1941–1946. Doi: 10.1073/pnas.1215165110.
Анастасия Горелова
elementy.ru
www.medicusamicus.com
| 








 Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог..
Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог.. включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн..
включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн.. Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп..
Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп.. Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас..
Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас..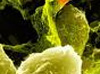 Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..
Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..



 Новости
Новости 
Рис. 3. MPL стимулирует фагоцитоз в клетках микроглии мыши. А — и MPL, и немодифицированный липополисахарид (LPS) стимулируют фагоцитоз флуоресцирующих бусин (Beads) Escherichia coli. B — внутриклеточная локализация этих гранул (зеленый) подтверждена данными конфокальной микроскопии. Длина масштабной линейки — 10 мкм. Рисунок из обсуждаемой статьи в PNAS