
|
|
|
Может ли улыбка улучшить настроение?
Улыбка на лице не всегда влияет на наши эмоции...
| 11 имплантируемых устройств, которые скоро будут у вас в теле.
Все вокруг обсуждают, как изменится мир с повсеместным использованием носимых электронных устройств - коммуникационных, медицинских, геопозиционных и т.п. Но мы полагаем, что эти т..
| Адъювантная химиотерапия при ранних стадиях рака молочной железы у пожилых больных: стандартные схемы эффективнее капецитабина.
 Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог.. Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог..
| Нормальное содержание фолиевой кислоты в организме женщины детородного возраста снижает риск развития пороков нервной трубки у детей.
 включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн.. включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн..
| Сравнительная эффективность антитромботических режимов при хронической сердечной недостаточности. Данные исследования WATCH
 Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп.. Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп..
| О безопасном применении жаропонижающих средств у детей
 Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас.. Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас..
| Гранулоцитарно-макрофагальный колониестимулирующий фактор не снижает частоту сепсиса и не улучшает выживание глубоко недоношенных младенцев
 Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с.. Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..
|
| Принципи ведення хворих з фібриляцією та тріпотінням передсердь
принципи ведення фібриляцією тріпотінням передсердь фібриляція тріпотіння рекомендації робочої групи порушень серцевого ритму українського наукового товариства кардіологів фібриляція передсердь ФП надшлуночкова тахіаритмія медикаментозна терапія хінідин дизопірамід аміодарон b-адреноблокаторами бета-адреноблокатори соталол пропафенон
артеріальна гіпертензія інфаркт міокарда ішемічна хвороба серця цукровий діабет систолічна дисфункція лівого шлуночка застійна серцева недостатність розмір лівого передсердя тромб ризик інсульт контроль частоти серцевих скорочень
Принципи ведення хворих з фібриляцією та тріпотінням передсердь
Рекомендації Робочої групи з порушень серцевого ритму Українського наукового товариства кардіологів
В рекомендаціях розглянуті основні принципи лікування хворих на фібриляцію та тріпотіння передсердь. Наведені матеріали мають суто практичне клінічне значення і можуть використовуватися медичними фахівцями різних профілів.
Передмова
Фібриляція передсердь (ФП) - надшлуночкова тахіаритмія, яка характеризується некоординованою активністю передсердь з погіршенням їх механічної функції.
Поширеність ФП у загальній популяції є найбільшою серед тахіаритмій і складає 0,4%; вона
збільшується по мірі старіння популяції та складає 0,1% у віці до 50 років і 9% після 80 років. Частота госпіталізацій з приводу ФП складає не менше 40% від усієї кількості госпіталізацій з приводу порушень серцевого ритму. Аритмічні симптоми, що значно погіршують якість життя пацієнтів, є основним приводом звертання за медичною допомогою.
Доведено, що ФП в 2 рази підвищує ризик смерті від усіх причин та в 2,4 рази - ризик смерті від серцевих причин.
Зважаючи на те, що пароксизмальна і постійна ФП погіршують прогноз виживання та якість життя хворих, доцільність лікування ФП безперечна.
Небезпека фібриляції передсердь передусім пов'язана з можливістю розвитку тромбоемболічних ускладнень і "тахікардіоміопатії", при якій на фоні високої частоти серцевих скорочень (ЧСС) виникають дилятація камер серця і дисфункція міокарда, що веде до формування або прогресування серцевої недостатності. Водночас можливості радикальної корекції ФП, на відміну від інших суправентрикулярних тахіаритмій, украй обмежені.
Хоча в значної кількості пацієнтів ФП асоціюється з наявністю серцево-судинної патології (гіпертензивне серце, ІХС, міокардит, кардіоміопатії, клапанні вади серця) та деяких некардіальних захворювань (хронічні неспецифічні захворювання легень, тиреотоксикоз), які можуть бути етіологічним фактором аритмії,
причинний зв'язок ФП з ними в більшості випадків не може бути доведений об'єктивно. До того ж майже 15% пацієнтів з постійною ФП та біля 40% з пароксизмальною формою аритмії не мають захворювань, які могли б бути її потенційною причиною.
Провідний електрофізіологічний механізм ФП - утворення у передсердях багатьох кіл зворотної циркуляції збудження, "micro re-entry", які постійно змінюють свою форму та розміри, "мандруючи" по передсердях, так що одні й ті ж ланки міокарда збуджуються фронтами деполяризації, що приходять з різних напрямків, на відміну від
атріовентрикулярних тахікардій, механізмом яких є рециркуляція хвилі збудження одним анатомічним колом. Чинниками, які провокують початок ФП, можуть бути ектопічна передсердна активність, зміни в частоті синусового ритму та поворотні регулярні надшлуночкові тахікардії.
Певну роль відіграє активність вегетативної нервової системи, активація однієї з ланок якої може виступати потужним тригером ФП. Ініціації та стабілізації аритмії сприяють дисперсія передсердної рефрактерності та швидкості проведення збудження, поява анатомічних ділянок блокади імпульсів, а також анатомічних кілець повторного
входу збудження. Тривале існування ФП веде до "електричного ремоделювання передсердь", яке включає скорочення ефективного рефрактерного періоду (ЕРП) та порушення частотної адаптації ЕРП, збільшення збудливості передсердь, дисперсії ЕРП та провідності, сповільнення проведення, дисфункцію синусового вузла.
Основу терапії ФП та попередження ускладнень складає медикаментозна терапія, оскільки переважна більшість пацієнтів з ФП є літнього віку і страждають від персистуючої або постійної ФП, при яких ефективність радіочастотної катетерної абляції вогнищ патологічного автоматизму та шляхів зворотної циркуляції збудження дуже низька.
Тріпотіння передсердь (ТП) є однією з найбільш поширених в клінічній практиці тахіаритмій, що за частотою виявлення посідає друге місце після ФП. Співвідношення ФП і ТП в середньому оцінюють як 5:1. Експериментальні та клінічні обстеження довели, що в основі ТП лежить механізм "macro re-entry" у передсердях.
Зважаючи на відмінності електрофізіологічних механізмів ФП і ТП, принципово відрізняється й тактика лікування цих аритмій. З іншого боку, поєднання ТП і ФП зустрічається у 20-30% хворих, і низка профілактичних та лікувальних заходів у цих випадках ідентичні.
Клінічна термінологія і класифікація
ФІБРИЛЯЦІЯ ТА ТРІПОТІННЯ ПЕРЕДСЕРДЬ
(форми)
Залежно від стану вегетативної нервової системи як модулюючого фактору виникнення ФП, пароксизми ФП поділяють також на вагусні, адренергічні та змішані. Переважання симпатичного або парасимпатичного тонусу є важливою точкою прикладення для диференційованого застосування антиаритмічних засобів.
Вагусні пароксизми ФП в типових випадках виникають у чоловіків середнього віку, які не мають вираженої органічної патології серця. Ці пароксизми часто спостерігаються після прийому надмірної кількості їжі, інколи - алкоголю. Пік їх формування припадає на вечірні та нічні години, вони не супроводжуються вираженою тахікардією і можуть поєднуватися з тріпотінням передсердь.
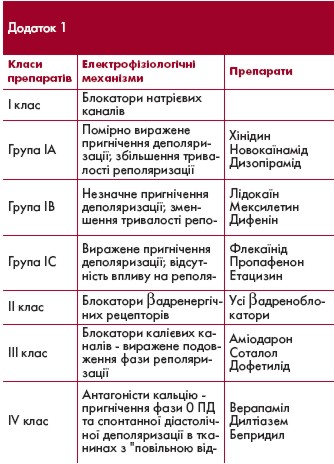
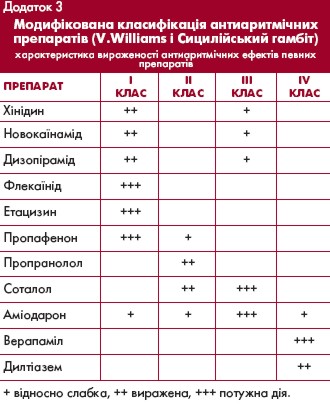
Розвитку цієї форми ФП передує сповільнення синусового ритму. Типові вагусні пароксизми з'являються, припиняються і потім знову виникають упродовж багатьох років без тенденції до формування постійної ФП. Найбільш ефективними при вагусних пароксизмах є антиаритмічні препарати 1А класу (хінідин, дизопірамід),
а також аміодарон.
Адренергічні пароксизми ФП більш характерні для пацієнтів із структурним захворюванням серця, передусім ІХС і похилого віку. Вони виникають на фоні тахікардії, при фізичному або психоемоційному стресі. Їх виникненню часто передує передсердна екстрасистолія. Вони краще піддаються терапії b-адреноблокаторами, аміодароном, соталолом і пропафеноном.
Найчастіше зустрічаються змішані пароксизми ФП з рисами вагусних та адренергічних пароксизмів, які вимагають індивідуалізованого добору терапії.
Обстеження пацієнтів з фібріляцією передсердь
Обстеження хворих на ФП та ТП має бути спрямоване на уточнення типу ФП/ТП, характеру захворювань, ускладнених аритмією, прогнозування перебігу ФП/ТП з урахуванням гемодинамічних порушень. Слід звернути увагу на наявність змін артеріального тиску, гострої чи посилення хронічної серцевої недостатності,
симптомів гіпоксичної енцефалопатії, анамнестичних вказівок про перенесені епізоди втрати свідомості, клінічної смерті з успішною реанімацією.
Необхідно своєчасно діагностувати синдром передчасного збудження шлуночків, синдром слабкості синусового вузла, синдром подовженого інтервалу QT, вивчати сімейний анамнез на предмет виявлення
провісників раптової смерті (ранній початок ІХС, артеріальної гіпертензії, кардіоміопатії, випадки раптової смерті батьків чи близьких родичів у віці до 50 років), виявляти виражену гіпертрофію лівого шлуночка, дилятацію камер серця, оцінювати ефективність і безпеку антиаритмічної терапії, яка призначалась у минулому. Опитування пацієнтів
з ФП спрямоване на оцінку наявності та типу симптомів, обставин виникнення порушення ритму, клінічної форми ФП, частоти та тривалості симптомних епізодів, дати виникнення першого та термінів останнього епізоду аритмії, попереднього прийому ліків, тривалості їх застосування, ефективності препаратів, особливостей клінічної симптоматики (табл. 1).
При вперше виявленій ФП потрібно зареєструвати ЕКГ у 12 відведеннях та здійснити аналіз крові на вміст тиреотропного гормону, при потребі - оцінку вмісту електролітів. Наявність структурного ураження міокарда уточнюють шляхом фізикального обстеження, ехокардіографічного дослідження М- і В-способами, при
якому особливу увагу звертають на функцію лівого шлуночка, розміри лівого передсердя, наявність тромбів у порожнинах серця (найбільш чутливий метод їх виявлення - черезстравохідна ехокардіографія).
У випадках, коли вирішується питання про немедикаментозне чи хірургічне (імплантація штучного водія ритму, абляція і так далі) лікування аритмії, хворим з ФП та ТП необхідно провести додаткові методи обстеження в умовах спеціалізованих кардіологічних, аритмологічних, кардіо-хірургічних відділень.
В окремих пацієнтів з пароксизмальною ФП доцільно здійснити холтерівське моніторування ЕКГ, яке дає змогу оцінити не лише частоту і тривалість пароксизмів, а й функціональний стан вегетативної нервової системи та його можливий зв'язок із "запуском" пароксизмів ФП, а також пробу з дозованим фізичним навантаженням.
До додаткових методів обстеження пацієнтів з ФП відносять також черезстравохідне ехокардіографічне дослідження (найбільш чутливий метод виявлення тромбів у порожнинах серця) і ендокардіальне електрофізіологічне
дослідження, яке переважно здійснюють у пацієнтів з ознаками передчасного збудження шлуночків і синкопальними станами.
Наголосимо, що електрофізіологічні методи обстеження та холтерівське моніторування ЕКГ дозволили протягом останніх двох десятиліть детальніше вивчити патогенез та клінічні варіанти ФП/ТП.
Додаткові обстеження:
1. Проба з фізичним навантаженням
- для оцінки адекватності контролю ЧСС у хворих на пароксизмальну та постійну форми ФП;
- індукція ФП при проведен ні проби;
- з метою оцінки наявності ішемії міокарда перед призначенням антиаритмічних засобів 1-го класу.
2. Холтерівське моніторування ЕКГ
- при неуточненому виді пароксизмальної тахіаритмії;
- для оцінки середньої ЧСС за добу.
3. Електрофізіологічне дослідження
- для уточнення механізму тахікардії з поширеними комплексами QRS;
- відтворення тахіаритмій, таких як ТП або пароксизми суправентрикулярної тахікардії;
- з метою встановлення зони для проведення абляції або деструкції/модифікації атріовентрикулярного (АВ) з'єднання.
Останнім часом важливе місце у вивченні патофізіологічних механізмів ФП/ТП посідає холтерівське моніторування ЕКГ. Цей метод дозволяє не лише виявляти аритмії, уточнювати механізми запуску та припинення, а й вивчати роль вегетативної нервової системи у патогенезі аритмії (варіабельність серцевого ритму) і стан субстрату аритмії (інтервал QT, дисперсія інтервалу QT).
Варіабельність серцевого ритму (ВСР) визначають як вираженість коливань ЧСС щодо її середнього рівня. Вивчення ВСР дозволяє оцінити вплив вегетативної нервової системи на патогенез виникнення ФП.
Показник SDNN (стандартне відхилення NN) відображає сумарну ВСР (норма 141+ 39 мс).
Значення менше 100 мс розцінюють як помірно знижене і можливий маркер виникнення життєво небезпечних аритмій. Показник LF (потужність у діапазоні низьких частот) відображає низькочастотну складову ВСР, що характеризує симпатичний тонус нервової системи (норма 1170+416 мс). HF (потужність у діапазоні високих частот) відображає високочастотну складову ВСР,
характеризує парасимпатичний тонус (норма 975+203 мс). Співвідношення LF/HF характеризує вегетативний баланс (норма 1,5-2,0).
Значення LF/HF більше 2,0 свідчить про активацію симпатичного тонусу, а менше 1,5 - перевагу парасимпатичного тонусу.
Інтервал QT відображає тривалість потенціалу дії клітин міокарду (електрична систола міокарда шлуночків). Для розрахунку нормальних величин інтервалу QT найбільше поширення отримала формула H. Bazett:
QTd = kRR, (де k - постійний коефіцієнт: у чоловіків - 0,37, у жінок - 0,40). На основі даної формули вираховують коригований інтервал QT: QTk=QTв/RR (де QTв - виміряний інтервал QT). Подовженим вважається інтервал QT, якщо він перевищує нормальну розрахункову величину на 0,03 с, або величина коригованого інтервалу QT перевищує 0,44 с.
Подовження інтервалу QT буває:
Гостре:
- отруєння речовинами, що мають кардіотоксичну дію і сповільнюють процес реполяризації шлуночків (фосфор, миш'як, ртуть, антиаритмічні препарати (хінідин, дизопірамід, новокаїнамід, аміодарон,
соталол, аймалін), психотропними препаратами (амітриптилін, аміназин), еритроміцин, бісептол (при внутрішньовенному введенні));
- порушення електролітного балансу (гіпокаліємія, гіпокальціємія, гіпомагніємія), внаслідок використання діуретиків;
- травми головного мозку;
- гострий інфаркт міокарда;
- інфекційне або алергічне ураження міокарда.
Хронічне:
- захворювання серцево-судинної системи (різні форми ІХС, артеріальна гіпертензія, дилятаційна і гіпертрофічна кардіоміопатії, застійна серцева недостатність, пролапс мітрального клапана, вроджені та набуті вади серця);
- патологічні стани, не пов'язані з первинним ураженням серця (цукровий діабет, хронічні неспецифічні захворювання легень, термінальна стадія хронічної ниркової недостатності, хвороба Бехчета, неврогенна анорексія).
Дисперсія інтервалу QT відображає електричну неоднорідність реполяризації шлуночків. Дисперсія інтервалу QT - різниця між максимальним і мінімальним інтервалами QT у 12 відведеннях ЕКГ (C. Day, 1990): dQT= QTmax - QTmin. Встановлено, що збільшення дисперсії інтервалу QT є маркером ішемії міокарда. Втім, діагностичне значення цього показника до кінця не встановлене.
Останнім часом велику увагу приділяють пізнім потенціалам передсердь як можливому неінвазивному маркеру появи ФП/ТП. Аналіз хвилі Р на ЕКГ високого посилення дозволяє виявити сповільнене фрагментоване проведення у передсердях та прогнозувати розвиток надшлуночкових тахіаритмій за механізмом зворотного входу збудження.
Аналізуються часові та амплітудні параметри хвилі Р. Зокрема, тривалість фільтрованої хвилі Р (FiP) >125 мc і середньоквадратична амплітуда останніх 20 мс хвилі Р (RMS-20) <3,0 мс свідчать про наявність пізніх потенціалів передсердь. Ці зміни реєструються в середньому у 80% хворих з пароксизмальною формою ФП/ТП.
Еталонним методом вивчення електрофізіологічних механізмів ФП/ТП продовжує залишатись електрофізіологічне дослідження. Втім, з діагностичною метою його доцільно здійснювати лише в окремих клінічних випадках.
Зокрема, реєстрація електрограми пучка Гiса дозволяє диференціювати шлуночкову екстрасистолію та аберантні комплекси QRS. Реєстрація потенціалу пучка Гiса на гістограмі та нормальна тривалість інтервалу HV дають змогу стверджувати, що шлуночкові комплекси є аберантними.
І, навпаки, відсутність потенціалу Н або значне вкорочення інтервалу HV характерні для шлуночкових екстрасистол. При ТП дуже чітко виділяються хвилі f, пов'язані або частково дисоційовані з шлуночковими комплексами.
Але основним показанням для проведення ЕФД у цієї категорії хворих є наявність синкопальних і передсинкопальних станів, які поєднуються з ознаками дисфункції синусового вузла на ЕКГ. Під час дослідження
вимірюють час відновлення функції синусового вузла (ЧВФСВ) та час синоатріального проведення (ЧСАП). Оскільки на ЧВФСВ впливає частота спонтанного синусового ритму, для оцінки автоматизму синусового вузла вимірюють коригований ЧВФСВ (КЧВФСВ).
Його визначають як різницю між ЧВФСВ і спонтанною тривалістю синусового циклу до стимуляції. ЧСАП визначають за методикою Narula Strauss. Можна здійснювати безпосереднє вимірювання ЧСАП з
використанням електродів, встановлених у ділянці синусового вузла. У нормі ЧВФСВ не перевищує 1500-2000 мс, а КЧВФСВ - 600 мс. Чутливість обох показників для виявлення дисфункції синусового вузла складає до 60%, специфічність - 88%. Таким
чином, нормальні значення цих показників не завжди дають змогу виключити наявність дисфункції синусового вузла.
Для оцінки функції АВ проведення досліджують точку Венкебаха. В нормі цей показник має бути не нижче 150 імпульсів на хвилину.
Програмована стимуляція серця та картування фокусів активації міокарда - основa для розробки нових методів лікування. Недостатня ефективність антиаритмічної терапії є вагомим стимулом для ширшого використання інвазивних методів лікування ФП/ТП.
Стратегія лікування фібриляції передсердь
Лікування ФП вирішує два головних завдання:
- зменшення клінічних симптомів;
- запобігання ускладненням (інсульти, серцева недостатність, інфаркт міокарда), що дозволяє зменшити захворюваність і смертність.
Зважаючи на те, що звичайно повністю усунути ФП не вдається, критеріями клінічної ефективності лікування є :
- фізіологічний контроль ЧСС;
- збільшення тривалості періоду до виникнення нового пароксизму;
- зменшення тяжкості та тривалості пароксизмів ФП;
- полегшення переносимості та припинення епізодів ФП;
- покращання якості життя.
В кожному клінічному випадку у пацієнтів з персистуючою формою ФП або частими пароксизмами ФП потрібно вирішувати основне питання - доцільність відновлення ритму з профілактикою подальших рецидивів ФП чи контролю ЧСС з тривалою антикоагулянтною терапією.
Вибір стратегії лікування визначається співвідношенням очікуваної ефективності та безпеки антиаритмічних медикаментів і антикоагулянтів, переносимістю препаратів, їх вартістю, впливом на якість життя, а також наявністю альтернативних шляхів ведення хворих.
Переваги відновлення та збереження синусового ритму:
- зменшення клінічних симптомів, спричинених аритмією;
- поліпшення стану гемодинаміки;
- підвищення толерантності до навантаження;
- психологічні переваги "нормального" ритму;
- можливо, поліпшення якості життя;
- відсутність потреби у тривалій антикоагулянтній терапії;
- зменшення ризику тромбоемболій.
Проблеми відновлення та збереження синусового ритму:
- низька ефективність більшості антиаритмічних засобів, виникнення та
необхідність припинення нових пароксизмів ФП;
- нормалізаційні" тромбоемболії після відновлення синусового ритму;
- погана переносимість антиаритмічних засобів;
- аритмогенні ефекти антиаритмічних засобів, найбільш виражені після відновлення синусового ритму;
- фоновий синдром слабкості синусового вузла або брадикардія у багатьох пацієнтів літнього віку;
- висока вартість лікування антиаритмічними засобами.
Переваги контролю частоти серцевих скорочень без відновлення синусового ритму:
- симптомне покращання, підвищення толерантності до навантаження;
- безпека лікування;
- добра переносимість медикаментів;
- відносно низька вартість лікування.
Проблеми контролю частоти серцевих скорочень без відновлення синусового ритму:
- менш адекватний, порівняно з фізіологічним, контроль ЧСС;
- втрата передсердного вкладу в серцевий викид;
- часте виникнення брадикардії, синдром "тахі-брадикардії";
- нерідко - необхідність пожиттєвого лікування антикоагулянтами;
- формування дилятації лівого передсердя та дисфункції лівого шлуночка при неадекватному контролі ЧСС;
- неповне усунення клінічних симптомів;
- зниження якості життя.
Питання про доцільність відновлення та збереження синусового ритму вирішують індивідуально, після ретельного порівняння переваг та недоліків певної стратегії лікування ФП у конкретному клінічному випадку.
Стратифікація ризику тромбоемболічних ускладнень
і антитромботична терапія
Імовірність виникнення інсульту та транзиторних порушень мозкового кровообігу при неревматичній ФП становить приблизно 5%, а в деяких підгрупах 8-12% на рік. Небезпека інсульту є найбільшою одразу і протягом першого року після початку ФП, а також після відновлення синусового ритму. Церебросудинні ускладнення ФП
особливо часто виникають у пацієнтів літнього віку. Слід розрізняти профілактику інсультів під час відновлення синусового ритму та при постійній формі ФП.
Запобігання тромбоемболічним ускладненням - один з найважливіших компонентів лікування ФП. Зважаючи на це, необхідно чітко поділяти хворих залежно від ступеня ризику інсульту.
Надзвичайно вагомим фактором ризику інсульту є мітральні вади серця, передусім мітральний стеноз. При ФП "неклапанного" генезу виникненню інсульту сприяють такі фактори:
- перенесені раніше емболії або інсульт;
- артеріальна гіпертензія;
- вік понад 65 років;
- інфаркт міокарда в анамнезі;
- ішемічна хвороба серця;
- цукровий діабет;
- виражена систолічна дисфункція лівого шлуночка і/або застійна серцева недостатність;
- збільшений розмір лівого передсердя (понад 50 мм), тромб у лівому передсерді.
Стратифікація ризику інсультів є провідним критерієм добору антитромботичної терапії при постійній формі ФП (табл. 2).
Короткочасний епізод ФП не асоціюється з підвищенням ризику тромбоемболій. Проте вже через 48 годин існування аритмії збільшується імовірність формування передсердних тромбів та тромбоемболічних ускладнень. Зважаючи на це, профілактична антикоагулянтна терапія показана хворим з персистуючою ФП (тривалістю понад
48 годин), яким запланована медикаментозна або електрична кардіоверсія, за відсутності умов для проведення черезстравохідної ехокардіографії, яка є надійним дiагностичним методом виключення тромбів у порожнинах серця.
Переважно застосовують непрямі антикоагулянти (варфарин, синкумар, фенілін). При їх використанні обов`язковим є ретельний контроль за станом системи згортання крові.
Найбільш точною є оцінка міжнародного нормалізаційного співвідношення (МНС), яка дає змогу стандартизувати результати, отримані в різних лабораторіях. Для профілактики інсульту при ФП у більшості випадків оптимальним вважається "помірний" режим гіпокоагуляції з досягненням та підтриманням рівня МНС в межах від 2 до 3, що орієнтовно відповідає протромбіновому індексу (ПТІ) 50-60%.
МНС розраховують за формулою:
МНС=(протромбіновий час пацієнта/контрольний протромбіновий час)ЧТ, де контрольний протромбіновий час - середній показник протромбінового часу, що виміряний у 20 здорових волонтерів за допомогою тромбопластину тієї ж серії, що використовувалася в пацієнта, а ЧТ - чутливість тромбопластину - показник
чутливості реагенту відносно стандартного тромбопластину, який контролюється Всесвітньою організацією охорони здоров'я і як референтний має індекс чутливості 1.
Для більшості тромбопластинів, які використовуються в західних країнах, ЧТ позначається
на упаковці. Для оцінки стану системи згортання крові МНС є надійнішим за ПТІ, тому що не залежить від якості реагенту.
На жаль, документація, яка додається до тромбопластинів, які використовуються сьогодні в більшості українських лабораторій, не містить інформації щодо чутливості реагенту.
Тому ПТІ лишається єдиним показником, за яким може здійснюватися контроль антикоагулянтної терапії. Його традиційно розраховують за формулою:
ПТІ=(контрольний протромбіновий час/ протромбіновий час пацієнта)х100%.
Непрямі антикоагулянти доцільно призначати в амбулаторних умовах під контролем показників згортання крові протягом трьох тижнів до і чотирьох (у деяких випадках - до двох місяців) - після кардіоверсії.
Ці терміни зумовлені тим, що на фоні терапевтичної гіпокоагуляції більшість тромбів розчинюються протягом трьох тижнів. Крім того, після відновлення синусового ритму механічна функція передсердь повністю відновлюється через кілька тижнів.
Відповідно, протягом цього часу зберігається підвищений ризик тромбоемболічних ускладнень. Адекватна гіпокоагуляція дозволяє знизити ризик "нормалізаційних" емболій з 2-5% до 0-0,5%. За необхідності у швидкому проведенні кардіоверсії можливо застосування прямих антикоагулянтів (нефракціонований гепарин або
низькомолекулярні гепарини). Спочатку здійснюється болюсна внутрішньовенна інфузія, потім - повільна інфузія до збільшення активованого часткового тромбопластинового часу (АЧТЧ) в 1,5-2 рази вище норми. Низькомолекулярні гепарини характеризуються більш передбачуваним антикоагулянтним ефектом, зручністю застосування, меншою
кількістю побічних реакцій (кровотеч, алергічних реакцій, тромбоцитопенії), простотою лабораторного контролю. Пізніше призначають пероральні антикоагулянти.
Оцінку МНС/ПТІ необхідно проводити кожен тиждень з початку пероральної антикоагулянтної терапії та кожен місяць після досягнення необхідного рівня МНС/ПТІ.
Дію антикоагулянтів потенціюють:
- нестероїдні протизапальні засоби;
- аміодарон;
- дігоксин;
- левоміцетин;
- бісептол;
- метронідазол;
- дифенін;
- фенобарбітал;
- фібрати.
Дію антикоагулянтів пригнічують:
- рифампіцин;
- ліпофільні b-адреноблокатори (метопролол, карведилол);
- циметидин;
- вазелінова олія.
Тактика ведення хворих
з пароксизмом фібриляції передсердь
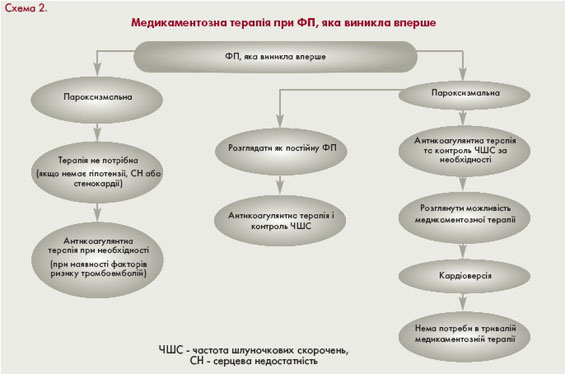
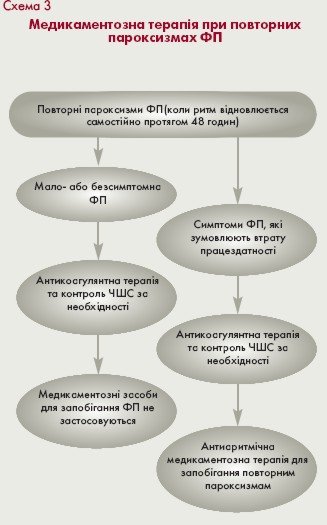
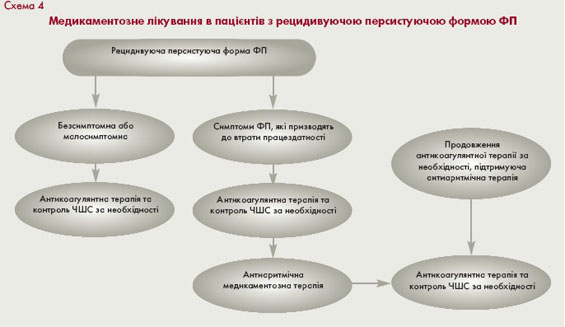
Особливості тактики ведення хворих з ФП, яка виникла вперше, повторними пароксизмами ФП та рецидивуючою персистуючою ФП подані у схемах 2, 3 і 4.
Контроль частоти серцевих скорочень під час підготовки до відновлення синусового ритму
Якщо під час пароксизму ФП порушень гемодинаміки та клінічних симптомів немає, здійснюють планове обстеження з метою визначення оптимальної програми ведення пацієнта. У 40-50% хворих з пароксизмами ФП синусовий ритм відновлюється самостійно протягом 72 годин.
Імовірність самостійного відновлення синусового ритму залежить від наявності супутньої патології: у хворих з кардіальною патологією частота самостійного відновлення становить до 20% випадків, у пацієнтів без захворювань серця - до 90%. У пацієнтів без структурного захворювання серця при вираженій тахікардії
доцільно призначити препарат з групи b-адреноблокаторів і/або седативний засіб. При збереженні аритмії пароксизм далі припиняють антиаритмічними препаратами або методом електричної кардіоверсії.
При симптомному пароксизмі з високою ЧСС тактика передусім залежить від прийому антиаритмічних засобів на момент пароксизму. Нерідко доза препаратів, які постійно приймає пацієнт, виявляється недостатньою. У цьому випадку для відновлення синусового ритму потрібно збільшити дозу антиаритмічного засобу.
Інколи виникає потреба у заміні препарату на інший або одночасному призначенні двох антиаритмічних препаратів. У випадку вираженої тахіаритмії до призначення засобів відновлення синусового ритму серця передусім потрібно сповільнити частоту шлуночкових скорочень. Залежно від особливостей клінічної ситуації
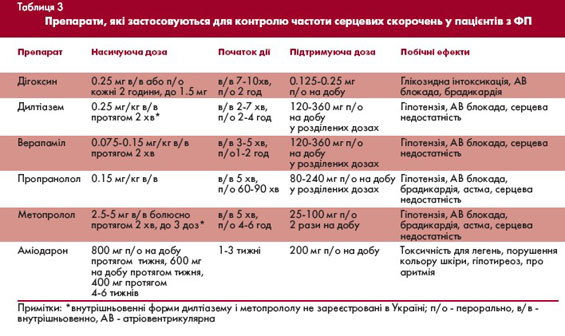
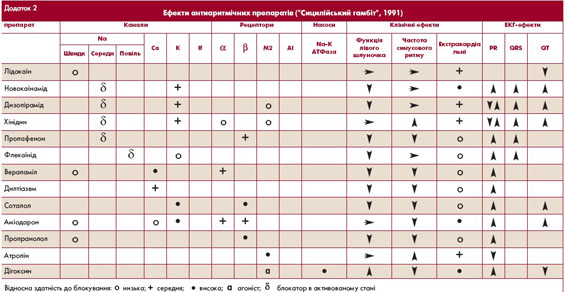
перевагу слід надавати дігоксину, аміодарону і/або b-адреноблокаторам (пропранолол, метопролол) чи недигідропіридиновим антагоністам кальцію (верапаміл, дилтіазем) (табл. 3).
Паралельно з лікувальними заходами здійснюють ехокардіографічне дослідження, оцінюють наявність тромбів у порожнинах серця, визначають стан системи згортання крові, призначають антикоагулянти і лише після адекватного сповільнення ЧШС - антиаритмічний засіб для відновлення синусового ритму.
Відновлення синусового ритму
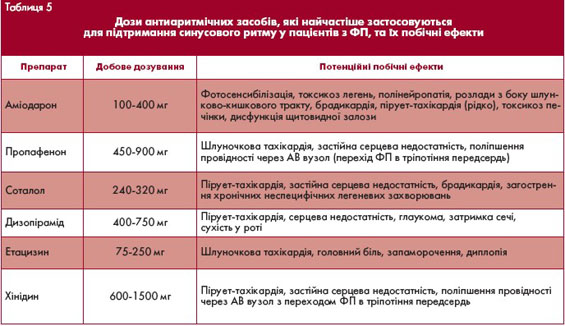
Співвідношення ефективності та безпеки застосування різних антиаритмічних засобів для відновлення синусового ритму серця значною мірою залежить від наявності та типу структурного захворювання серця. В таблиці 4 наведені дози препаратів, які найчастіше використовуються для відновлення синусового ритму.
Крім того, існують значні відмінності швидкості відновлення синусового ритму залежно від обраного препарату та способу його введення.
Зокрема, ефективність пропафенону при застосуванні внутрішньовенної форми препарату становить в середньому до 90% протягом 1 години, пероральної форми - 70% протягом 8 годин. Препарати 3-го класу рідко дозволяють швидко відновлювати синусовий ритм, а ефективність соталолу для припинення ФП є дуже низькою також і при тривалому застосуванні. З іншого боку, протягом 24 годин після внутрішньовенного введення аміодарону, подібно до
перорального прийому хінідину, ритм відновлюється більш ніж у 80% пацієнтів з пароксизмальною ФП. Перевага аміодарону порівняно з препаратами 1-го класу полягає у сповільненні частоти скорочень шлуночків, що дозволяє уникнути небезпеки переходу ФП в тріпотіння передсердь з проведенням 1:1 або 2:1 з вираженою тахікардією.
Аміодарон є також оптимальним засобом вибору за наявності порушень гемодинаміки, зважаючи на те, що цей препарат має менш виражену негативну інотропну (а також аритмогенну) дію порівняно з препаратами 1-го класу. Дігоксин, b-адреноблокатори і недигідропіридинові антагоністи кальцію неефективні для швидкого
відновлення синусового ритму, але корисні для сповільнення ЧШС до здійснення медикаментозної кардіоверсії. Втім, існує певна імовірність спонтанного відновлення синусового ритму після зменшення тахікардії, наприклад після введення дігоксину пацієнтам з серцевою недостатністю.
Якщо ФП виникає у пацієнтів без виражених ознак структурного ураження серця, на яких припадає до 30% усіх пацієнтів з ФП, перевагу надають пропафенону, дизопіраміду, хінідину. При їх неефективності для припинення пароксизму можна внутрішньовенно застосувати новокаїнамід або аміодарон. У випадку застійної серцевої
недостатності і/або дисфункції лівого шлуночка спочатку вводять серцеві глікозиди для зменшення частоти серцевих скорочень. Найбільш безпечний засіб припинення пароксизмів у цієї категорії пацієнтів - аміодарон.
Аміодарон, пропафенон, дизопірамід і хінідин дозволяють відновлювати синусовий ритм приблизно у 50% пацієнтів з персистуючою ФП. Зазначимо, що ефект препаратів 1-го класу досягається швидше і кількість пацієнтів з відновленням синусового ритму досягає максимального рівня через 2 тижні після початку лікування, тоді
як при застосуванні аміодарону у багатьох з них ритм може відновлюватися в амбулаторних умовах через 4 тижні і пізніше. Втім, хінідин, дизопірамід і пропафенон можуть істотно збільшувати частоту серцевих скорочень.
Крім того, хронічне застосування антиаритмічних засобів 1-го і 3-го класів (крім аміодарону) в амбулаторних умовах може бути небезпечним через зростання ризику пірует-тахікардії та інших проявів аритмогенної
дії після відновлення синусового ритму. Самостійне припинення пароксизму можливе при незначній тривалості, за умови клінічно стабільного стану та попереднього досвіду застосування відповідного антиаритмічного препарату.
Електроімпульсна терапія
Вибір терапевтичної тактики при пароксизмі ФП передусім залежить від стану гемодинаміки.
1.Невідкладну електричну кардіоверсію потрібно здійснювати:
- при пароксизмі ФП з високою ЧШС, на фоні гострого інфаркту міокарда, нестабільної стенокардії;
- при пароксизмі ФП, який супроводжується симптомною гіпотензією, гострою або прогресуючою хронічною серцевою недостатністю;
- тяжкому пароксизмі ФП, який не піддається медикаментозному лікуванню.
2. Кардіоверсія у пацієнтів без ознак гемодинамічної нестабільності виконується за наявності виражених клінічних симптомів ФП.
Тактика ведення пацієнтів з пароксизмами ФП на фоні хронічної серцевої недостатності, зокрема вирішення питання про доцільність та терміни електричної кардіоверсії має певні особливості.
Переваги негайної кардіоверсії:
- запобігання електричному ремоделюванню передсердь;
- поліпшення стану гемодинаміки та зменшення проявів серцевої недостатності при відновленні регулярного та більш повільного ритму серця;
- уникнення застосування препаратів з негативною інотропною дією для відновлення синусового ритму;
- труднощі контролю частоти серцевих скорочень при ФП у пацієнтів з серцевою недостатністю.
Недоліки негайної кардіоверсії та аргументи за її більш пізнє проведення:
- низька ймовірність відновлення синусового ритму при підвищенні симпатичного тонусу та гіперкатехоламінемії;
- збільшення ризику загальної анестезії у пацієнтів з набряком легень або тяжкою серцевою недостатністю;
- труднощі встановлення часу початку ФП;
- ризик "нормалізаційних" емболій;
- висока частота швидкого спонтанного відновлення ритму на фоні оптимізації стану гемодинаміки (приблизно у 50% пацієнтів з ФП, яка вперше виникла, ритм спонтанно відновлюється протягом 24-48 годин).
Електрична кардіоверсія є більш ефективною при персистуючій ФП (ефективність 80-98%), ніж медикаментозна, і тому в багатьох випадках їй надається перевага як оптимальному методу планового відновлення синусового ритму.
Показання до планової електричної кардіоверсії при ФП:
- неефективність медикаментозної терапії;
- непереносимість антиаритмічних засобів або ризик, пов'язаний з їх призначенням;
- прогресування серцевої недостатності, погіршення кровопостачання
серця, мозку, нижніх кінцівок, пов'язане з тахіаритмією;
- дані про те, що лише електрична кардіоверсія була раніше ефективна для відновлення синусового ритму при ФП.
Протипоказання до електричної кардіоверсії:
- інтоксикація серцевими глікозидами;
- гіпокаліємія;
- гострі інфекційні захворювання;
- некомпенсована хронічна серцева недостатність.
Підготовка до планової електричної кардіоверсії:
- За 3-5 діб до кардіоверсії - відміна серцевих глікозидів та діуретиків.
- Корекція порушень електролітного обміну шляхом планового внутрішньовенного введення глюкозо-інсулін-калієвої суміші.
- Призначення антиаритмічних засобів для досягнення їх фонової концентрації (хінідин, дизопірамід, етацизин - у середніх добових дозах, аміодарон - в насичуючих дозах).
- Призначення прямих або непрямих антикоагулянтів.
- За 30-40 хвилин до кардіоверсії - підшкірне введення 1 мл 2% розчину промедолу та 0,5-1 мл 0,1% атропіну.
- Після введення промедолу починають інфузію глюкозо-інсулін-калієвої суміші.
Електричну кардіоверсію здійснюють натще, наркоз забезпечують шляхом внутрішньовенного введення гексеналу, тіопенталу або сомбревіну.
Методика електричної кардіоверсії:
Електроди дефібрилятора змащують спеціальною пастою чи змочують прокладки ізотонічним розчином повареної солі. Один електрод (активний) розташовують в ділянці верхівкового поштовху, другий - справа від грудини в ділянці ІІ-ІІІ міжребер'я під правою ключицею чи зліва між лопатками. Необхідно перевірити синхронізацію за монітором.
Початкова енергія при стабільному стані хворого - 25 Дж при ТП, 100 Дж - при ФП. За необхідності енергію розряду ступінчато підвищують до 100, 200, 300, 360 Дж. У випадку раннього рецидиву ФП (протягом перших секунд або хвилин) подальше збільшення енергії розряду не має сенсу.
Ускладнення електроімпульсної терапії:
- системна емболія;
- шлуночкова тахікардія і фібриляція шлуночків;
- гостра лівошлуночкова недостатність;
- пошкодження міокарда;
- екстрасистолія, синусова тахікардія, синусова брадикардія;
- гіпотензія.
Пiдтримуюча антиаритмiчна терапiя
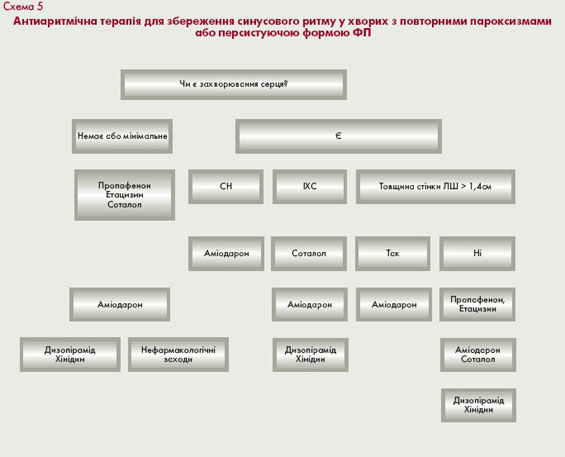
Тактика вибору засобів підтримуючої антиаритмічної терапії у пацієнтів з пароксизмальною ФП визначається кількома факторами: наявністю і характером захворювання серця (схема 5), частотою та клінічним перебігом пароксизмів, побічними ефектами (табл. 5) та вартістю препаратів. Мета лікування - зменшення частоти, тривалості і покращання переносимості пароксизмів, забезпечення можливості їх самостійного припинення в амбулаторних умовах.
Якщо приступи пароксизмальної ФП виникають часто, ефект нерідко забезпечується шляхом усунення запускаючих факторів, таких як прийом кофеїну, алкоголю, стресів, а також лікування хронічних захворювань: ІХС, тиреотоксикозу та серцевої недостатності. Препарати 1С класу (пропафенон) ефективні у багатьох пацієнтів
з ФП, але не повинні призначатися пацієнтам після перенесеного інфаркту міокарда і з дисфункцією лівого шлуночка через небезпеку аритмогенної дії.
Ефективність соталолу подібна до препаратів 1-го класу: так само як і при застосуванні пропафенону, більш ніж у 50% пацієнтів протягом 6 місяців після кардіоверсії виникають рецидиви ФП, тоді як при збільшенні дози препарату зростає небезпека його аритмогенних ефектів. Втім, засто-сування соталолу більш
безпечне порівняно з препаратами 1-го класу у пацієнтів з ІХС без систолічної дисфункції лівого шлуночка і серцевої недостатності. Тривале використання хінідину у пацієнтів з пароксизмальною ФП недоцільне, зважаючи на часте виникнення різноманітних побічних ефектів та повідомлення про збільшення імовірності смерті з різних причин. Найважливіша проблема, пов'язана з тривалим прийомом аміодарону - відносно висока частота побічних екстракардіальних ефектів.
З іншого боку, аміодарон є найбільш ефективним засобом профілактики пароксизмальної та персистуючої ФП. Його доцільно застосовувати при ФП на фоні ішемічної хвороби серця, систолічної дисфункції
міокарда і серцевої недостатності, а також у випадках рефрактерності до інших антиаритмічних препаратів, коли користь застосування аміодарону для запобігання аритмії, пов'язаним з нею симптомам і ускладненням безумовно виправдовує деякий ризик позасерцевих побічних ефектів.
Оцінка очікуваної ефективності та переносимості терапії дозволяє у кожному конкретному випадку обрати антиаритмічний засіб, оптимальний для початку лікування. За відсутності ішемії та тяжких структурних уражень міокарда передусім призначають антиаритмічні препарати 1С або 1А класів, такі як пропафенон
або дизопірамід. У пацієнтів з ішемічною хворобою серця без дисфункції лівого шлуночка препаратами першого вибору є соталол або аміодарон, а не препарати 1-го класу, які частіше викликають аритмогенні ефекти. За наявності серцевої недостатності найбільш безпечним та ефективним препаратом є аміодарон.
З ускладнень антиаритмічної терапії при ФП найбільш небезпечним є виникнення шлуночкової тахікардії. Тому при призначенні терапії потрібно враховувати наявність у пацієнта предикторів її виникнення (табл. 6).
Організація надання допомоги хворим з ФП
Від прийняття рішення про початок надання допомоги в стаціонарі чи амбулаторних умовах залежать не лише ефективність та безпека, а й вартість лікування, а також значною мірою - психологічний стан та якість
життя пацієнта. Специфічних досліджень та категоричних рекомендацій з цього питання немає; наголосимо, що рішення залежить від національних та регіональних особливостей організації системи надання допомоги кардіологічним хворим. У кожному випадку воно приймається індивідуалізовано, з урахуванням таких факторів:
- стабільність стану гемодинаміки;
- наявність структурного захворювання серця;
- вибір антиаритмічних засобів;
- необхідність в антикоагулянтній терапії.
Початок лікування в умовах стаціонару доцільний за наявності таких факторів:
- структурне захворювання серця як причина ФП (особливо серцева недостатність і систолічна дисфункція лівого шлуночка);
- нестабільність стану гемодинаміки та виражені клінічні симптоми;
- використання антиаритмічних засобів 1а або 3-го класу (крім аміодарону) без попереднього досвіду їх застосування у конкретного пацієнта;
- наявність факторів ризику емболій.
Початок лікування в амбулаторних умовах можливий за таких умов:
- ідіопатична ФП;
- припинення паро ксизмів ФП таблетованими формами антиаритмічних засобів при наявності попереднього досвіду їх застосування;
- персистуюча ФП із стабільним станом гемодинаміки при призначенні непрямих антикоагулянтів до виконання кардіоверсії;
- пароксизмальна ФП в анамнезі, адекватна антикоагуляція;
Продовження лікування в умовах санаторію кардіологічного профілю. На підставі наказу МОЗ України №206 від 30.10.1992 року санаторно-курортному лікуванню підлягають хворі:
- з пароксизмальною або персистуючою формами ФП/ТП після відновлення синусового ритму та підбору адекватної протирецидивної терапії.
Контроль частоти серцевих скорочень при постійній формі фібриляції передсердь
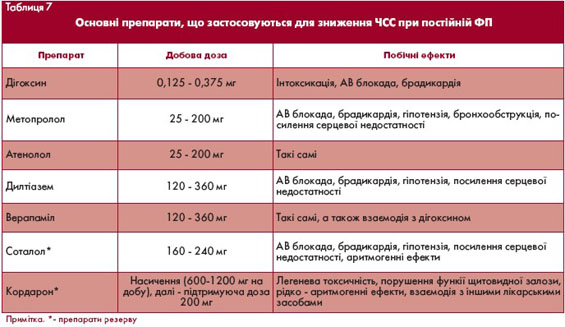
Більшість хворих з постійною формою ФП потребують зниження частоти шлуночкових скорочень (ЧШС). Це зумовлено кількома причинами. По-перше, висока ЧШС може значно погіршувати стан гемодинаміки
у пацієнтів з серцевою недостатністю. По-друге, тривала тахікардія здатна призводити до формування серцевої недостатності через виникнення "тахікардіоміопатії" - зворотної дилятації порожнин серця.
Врешті-решт, при ФП часті неритмічні серцеві скорочення звичайно супроводжуються різноманітними відчуттями, які істотно погіршують якість життя пацієнтів.
Оптимальною є частота шлуночкових скорочень (ЧШС) 60-80 на хвилину, проте на практиці у багатьох пацієнтів зменшення ЧШС у спокої нижче 80 на хвилину виявляється недоцільним і навіть супроводжується погіршенням стану гемодинаміки. ЧШС у хворих з ФП розглядається як контрольована, коли середня ЧШС у спокої не
перевищує 80-90 ударів на хвилину, а під час субмаксимального навантаження - 120 на хвилину. При проведенні холтерівського моніторування ЕКГ застосовують додаткові критерії: середньодобова ЧШС не повинна перевищувати 80 на хвилину, до того ж не повинно бути епізодів, коли протягом години середня ЧШС перевищує 100 на хвилину.
Оскільки ЧШС при ФП визначається електрофізіологічними властивостями АВ вузла, для контролю ЧШС застосовують заходи, спрямовані на зміну цих властивостей. Зниження ЧШС можна досягнути за допомогою медикаментів, які збільшують рефрактерність АВ вузла та сповільнюють провідність, або радіочастотної модифікації чи абляції АВ вузла.
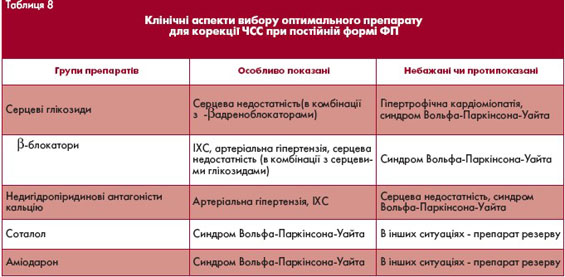
Серед медикаментів для зменшення ЧШС застосовують серцеві глікозиди, b-адреноблокатори та недигідропіридинові антагоністи кальцію.
Препаратами вибору для зниження ЧШС при ФП до останнього часу вважались серцеві глікозиди. Основні переваги глікозидів полягають в їх позитивному інотропному ефекті, доступності та зручності застосування.
Проте адекватно контролюючи ЧШС у спокої, ці препарати майже повністю втрачають свій ефект при навантаженнях. Основний механізм зменшення ЧШС на фоні застосування серцевих глікозидів - стимуляція парасимпатичного відділу вегетативної нервової системи.
При фізичних навантаженнях та емоційному стресі істотно збільшується активність симпатичного відділу, а це нерідко зумовлює втрату ефекту серцевих глікозидів. Ще одним важливим недоліком цієї групи препаратів є їх вузька терапевтична широта.
Останнім часом реальною альтернативою глікозидам стали b-адреноблокатори та недигідропіридинові антагоністи кальцію. За здатністю сповільнювати ЧШС у спокої вони не поступаються дігоксину, тоді як при навантаженні мають переваги. Вони особливо показані пацієнтам, в яких ФП поєднується з артеріальною гіпертензією чи ІХС. Зокрема,
антагоністи кальцію можна застосовувати у пацієнтів з бронхоспастичним синдромом, порушеннями периферичного кровообігу, цукровим діабетом.
З іншого боку, вони протипоказані при систолічній дисфункції, застійній серцевій недостатності, тоді як b-адреноблокатори є стандартними засобами лікування цієї категорії пацієнтів після стабілізації стану гемодинаміки.
У пацієнтів з застійною серцевою недостатністю та ФП препаратом першого вибору для зниження ЧШС є дігоксин. У багатьох випадках виправданим є поєднання двох препаратів, здатних сповільнювати ЧШС, наприклад, дігоксину і b-адреноблокатора.
Немедикаментозне лікування ФП
До цього часу основним методом лікування ФП залишається медикаментозна терапія. Проте в частини хворих з ФП вона неефективна або неможлива через значні побічні ефекти. В таких випадках використовують ряд немедикаментозних методів лікування.
У ситуаціях, коли медикаменти виявляються неефективними для контролю ЧСС, викликають
побічні ефекти або існують протипоказання до їх прийому, альтернативою є метод катетерної радіочастотної абляції з деструкцією або модифікацією АВ вузла. Деструкція АВ вузла повністю перериває проходження імпульсів від передсердь до шлуночків і вимагає подальшої імплантації кардіостимулятора.
В пацієнтів з пароксизмальною ФП найоптимальнішим режимом стимуляції є DDD(R)-MS, а в пацієнтів із постійною ФП - VVIR. Імплантація ЕКС, здатних лише до стимуляції в режимі VVI, можлива лише в окремих випадках - головним чином, у пацієнтів старечого віку або тяжко хворих, оскільки веде до зниження загальної
якості життя. Методика модифікації АВ вузла радіочастотною енергією дозволяє зменшити ЧСС внаслідок підвищення рефрактерності "швидкого" чи "повільного" шляхів проведення імпульсів. Успіх досягається у 65-75% випадків, але АВ блокада з необхідністю імплантації кардіостимулятора виникає майже у 15% пацієнтів.
Катетерна зміна атріовентрикулярної провідності шляхом створення повної АВ блокади або так званої її модифікації, коли ЧШС знижується порівняно з початковою на 30-50%.
Перевагами катетерної деструкції АВ вузла є технічна простота та досягнення ефекту практично в 100% випадків. У більшості випадків після деструкції АВ вузла відмічають покращання якості життя, функціональної здатності і функції лівого шлуночка. До недоліків процедури слід віднести її паліативний характер
(вона не впливає на перебіг ФП), а також необхідність пожиттєвої електрокардіостимуляції (ЕКС). З цієї точки зору більш доцільною є модифікація АВ провідності, при якої досягнути бажаного ефекту вдається в 60-85%, при цьому в подальшому пацієнт не потребує ЕКС. Показом для створення повної АВ блокади або модифікації АВ провідності є постійна ФП з погано контрольованою ЧШС, особливо якщо є дані за кардіоміопатію, викликану тахікардією.
У випадках пароксизмальної ФП такі процедури показані лише тоді, коли ЧШС при приступі настільки велика, що може призвести до гострої СН.
Стимуляція передсердь з метою профілактики ФП
У хворих з "ваготонічною" ФП, а також з дисфункцією синусового вузла постійна стимуляція передсердь є найкращим методом профілактики пароксизмів ФП. При цьому стимуляція передсердь у двох місцях
більш ефективна, ніж в одному. Водночас у значної частини таких хворих зберігається потреба в додатковому прийомі антиаритмічних препаратів. Моно- або біфокальну стимуляцію передсердь для профілактики ФП доцільно використовувати лише у випадках, коли є покази для імплантації ЕКС внаслідок брадикардії.
Хірургічне лікування ФП
Створення анатомічних бар'єрів у передсердях може зменшити число циркулюючих хвиль збудження до рівня, нижче необхідного для підтримки ФП. Так звана операція "лабіринт" та її модифікації, при яких в передсердях виконуються серії розрізів, дозволяють надійно вилікувати від ФП більш ніж 90% хворих.
Недоліками операції є її більша травматичність, а також те, що приблизно 6% з числа прооперованих хворих надалі потрібна імплантація електрокардіостимулятора. Операція "лабіринт" показана також як додатковий етап при кардіохірургічних операціях з приводу різних структурних патологій серця з супутньою ФП.
Катетерне лікування ФП
Розрізняють два принципово різних напрямки:
1. Фокальне усунення аритмії передбачає ліквідацію вогнищ індукції ФП. У 95% випадків такі вогнища розміщені в м'язових волокнах легеневих вен. Спершу процедура фокальної ліквідації ФП включала в себе пошук "вогнищ-тригерів". Але, зважаючи на важкість і тривалість такого пошуку, зараз більш поширені процедури електричної ізоляції легеневих вен.
В лівому передсерді навколо гирл легеневих вен при нанесенні послідовних аплікацій створюється бар'єр, який заважає поширенню збудження від вогнищ, розташованих в легеневих венах. Така процедура дозволяє позбавити від повторних пароксизмів ФП приблизно 80% хворих. При хронічній ФП вона дає позитивний ефект в кращих клініках світу приблизно у 65% випадків.
]
2. Метод лінійних аплікацій. Цей метод передбачає створення ліній блоку для циркуляції збудження шляхом нанесення послідовних аплікацій. Нанесення лінійних аплікацій приблизно в 60% випадків і додатково у 20% дозволяє контролювати пароксизми ФП з допомогою антиаритмічних препаратів, які раніше були неефективні.
В даний час у пацієнтів з ФП, рефрактерною до медикаментозної терапії, з нормальними або помірно збільшеними розмірами лівого передсердя методом вибору є процедура ізоляції гирл легеневих вен.
Таким чином, у пацієнтів з ФП, у яких не може бути досягнутий достатньо надійний контроль аритмії з допомогою медикаментозної терапії, найкращий спосіб немедикаментозного лікування визначається індивідуально. Так, наприклад, при кардіоміопатії у пацієнтів з хронічною ФП і високою частотою скорочень
шлуночків оптимальним шляхом лікування може бути модифікація АВ провідності. Хворим з дисфункцією синусового вузла може бути рекомендована передсердна стимуляція (краще біатріальна). У хворих з ідіопатичною ФП найбільш перспективною вважається ізоляція гирл легеневих вен.
Показання для хірургічних методів лікування ФП:
- Неефективність антиаритмічної терапії, що проводиться в адекватних дозах.
- Аритмогенна дія антиаритмічних засобів.
- Гемодинамічно значущі приступи ФП.
- Поєднання ФП з синдромом передчасного збудження шлуночків.
- Синдром слабості синусового вузла, "тахі-бради" форма з вираженою брадикардією, що потребує імплантації ЕКС.
- Синдром Фредеріка.
ТРІПОТІННЯ ПЕРЕДСЕРДЬ
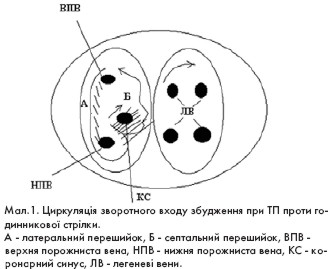
Типове ТП характеризується великоамплітудними хвилями F негативної полярності у відведеннях II, III, AVF з частотою 220-320 на хвилину. В цьому випадку циркуляція петлі зворотного входу збудження в правому передсерді відбувається проти годинникової стрілки навколо тристулкового клапана (краніо-каудальний напрямок). Даний варіант зустрічається у 90-95% випадків ТП (мал. 1).
Другий варіант типового ТП характеризується наявністю позитивних хвиль F у нижніх стандартних відведеннях. В цьому випадку повторний вхід збудження відбувається в протилежному напрямку - за годинниковою стрілкою.
Критичною зоною сповільненого проведення петлі re-entry в обох випадках є зона між нижньою порожнинною веною (НПВ) і септальною стулкою тристулкового клапана (ТК) - так званий істмус, в місці якого
для радикального усунення ТП може здійснюватись катетерна радіочастотна абляція (КРА). Створення лінії безперервного пошкодження між НПВ та ТК забезпечує усунення ТП і робить неможливим рух macro re-entry ТП довкола ТК.
При істмус-залежних типах ТП (95% всіх типів ТП) методом вибору сьогодні є КРА.
Окрему форму являє поєднання ФП і ТП. ФП зустрічається у 10-30% хворих з ТП. У 10-20% випадків в пацієнтів з ФП, які приймають антиаритмічні препарати І класу і аміодарон, виникає ТП, яке раніше не реєструвалось, рефрактерне до медикаментозної терапії і коригується лише немедикаментозними методами.
Клінічні прояви
ТП є значною клінічною проблемою в зв'язку з тим, що у частини хворих з ТП можуть виникати тромбоемболічні ускладнення, особливо при поєднанні з ФП. При хронічному перебігу ТП може виникати або посилюватись серцева недостатність ("тахікардіоміопатія"). Перебіг симптомний, хворі часто скаржаться на біль в грудній клітині, інколи виникають синкопальні стани.
Діагноз
В більшості випадків ТП, так само як ФП, діагностують за поверхневою ЕКГ. Найбільш поширеним електрокардіографічним варіантом ТП є типове ТП (негативні хвилі F в вiдведеннях II, III, AVF) з частотою
скорочень передсердь 260-320 на хвилину та проведенням на шлуночки 2:1-4:1. У деяких випадках для кращої візуалізації зубців F необхідно використовувати вагусні проби або фармакологічні препарати, які сповільнюють АВ проведення (аденозинтрифосфат внутрішньовенно 3-6 мг, верапаміл внутрішньовенно 5-10 мг).
У випадку регулярної тахікардії з частотою 140-150 на хвилину передусім необхідно виключити можливість ТП. У сумнівних випадках необхідно зареєструвати стравохідну або ендокардіальну електрограми.
Лікування ТП передбачає:
- Відновлення синусового ритму шляхом застосування антиаритмічних препаратів, електроімпульсної терапії, кардіостимуляції.
- Профілактичний прийом антиаритмічних засобів для запобігання рецидивам ТП.
- Катетерну радіочастотну абляцію для радикального усунення анатомічного субстрату ТП.
Відновлення синусового ритму. Оптимальна тактика відновлення серцевого ритму залежить
від клінічного стану хворого. При виражених гемодинамічних порушеннях перевагу надають черезстравохідній електрокардіостимуляції або електроімпульсній терапії. Ефективність внутрішньовенного введення антиаритмічних засобів для припинення ТП невелика і в середньому не перевищує 20-30%. У західних країнах останнім часом для припинення ТП використовують ібутилід (блокатор калієвих каналів), ефективність якого досягає 60%.
Антиаритмічні препарати при лікуванні нападів ТП призначають з метою:
- Зниження ЧСС ( b-адреноблокатори, кальцієві антагоністи, дігоксин та
їх поєднання).
- Посилення ефективності частотної та ендокардіальної стимуляції (новокаїнамід, пропафенон, аміодарон).
- Профілактики ранніх рецидивів ТП після відновлення синусового ритму (препарати ІА, ІС, ІІІ класів).
При призначенні препаратів І класу необхідно зважати на небезпеку покращання АВ провідності до 1:1 з підвищенням ЧСШ до 200-220 на хвилину.
Електроімпульсна терапія - найбільш ефективний і безпечний метод відновлення синусового ритму при нападі ТП. Її ефективність наближається до 100%.
Потужність електричного розряду складає 100-150 Дж.
Ще один простий і безпечний метод припинення нападу ТП - черезстравохідна електрокардіостимуляція, ефективність якої становить 25-35%, а при фоновому застосуванні антиаритмічних засобів зростає до 50%. Частота стимуляції повинна на 10-20% переважати частоту власних передсердних скорочень, а її тривалість -
становити 5-10 секунд. Звичайно можна здійснити 10-15 спроб відновлення синусового ритму, в деяких випадках корисно змінити положення зонда-електрода. Якщо не вдається припинити ТП в такому режимі, частоту стимуляції збільшують до 400-500 на хвилину.
У цьому випадку зростає імовірність індукції ФП, яку легше припинити внутрішньовенним введенням антиаритмічних засобів. Ендокардіальна ЕКС більш ефективна, але потребує спеціальних навичок та відповідних умов для здійснення.
Профілактична антиаритмічна терапія
Антиаритмічні засоби для профілактичного прийому призначають більшості хворих з рецидивуючим ТП. Але навіть на фоні медикаментозного лікування рецидиви ТП та ФП виникають в 50-70% хворих протягом перших 12 міс. Для тривалої профілактичної терапії у хворих без тяжкої структурної патології міокарда можуть застосовуватися препарати ІС класу (флекаїнід, пропафенон), а також етацизин.
У контрольованих дослідженнях доведена ефективність препаратів ІІІ класу аміодарону і соталолу. Найбільш ефективним засобом запобігання ТП є аміодарон, який може бути препаратом вибору за наявності виражених структурних змін міокарда і низької (30%) фракції викиду.
Антикоагулянтна терапія
Зважаючи на те, що у багатьох хворих ТП поєднується з ФП, принципи антикоагулянтної терапії у хворих ТП є подібними до таких при ФП.
За умов, коли лише в небагатьох клініках виконують черезстравохідну ехокардіографію, при тривалості пароксизму ТП понад 48-72 годин непрямі антикоагулянти доцільно призначати протягом 3 тижнів до і 4
тижнів після відновлення серцевого ритму з підтриманням ПТІ на рівні 50-60%. Хворим без тяжкої структурної патології міокарда можна призначати прямі антикоагулянти протягом 3-5 днів до відновлення серцевого ритму і непрямі антикоагулянти протягом 4 тижнів після кардіоверсії.
Постійну антикоагулянтну терапію призначають при хронічних формах ТП, коли є фактори ризику тромбоемболій.
Радіочастотна катетерна абляція
Висока ефективність радіочастотної катетерної абляції (КРА) та відносна простота цієї маніпуляції, а також незадовільні результати тривалої профілактичної терапії ТП призвели до того, що КРА сьогодні є методом вибору при рецидивуючих формах ТП.
Тому КРА доцільно виконувати не лише при неефективності антиаритмічних засобів, а й за необхідності їх тривалого профілактичного прийому. Ефективність КРА у подоланні ТП досягає 95%, кількість рецидивів - 10%, загрожуючі життю ускладнення майже не виникають. Процедура здійснюється трансвенозно, без загальної
анестезії, добре переноситься. Мета КРА - усунення ТП і створення двонаправленої блокади проведення по перешийку, яка досягається шляхом створення лінії безперервного пошкодження при нанесенні точкових аплікацій шляхом витягування абляційного електрода до НПВ.
Кількість аплікацій становить 30-40, звичайна тривалість процедури - 1,5-2,5 годин. Повторні процедури здійснюються значно швидше, потребують 3-5 аплікацій і ефективні в 100% випадків.
ВЕДЕННЯ ХВОРИХ З ФП ЗА НАЯВНОСТІ СУПУТНІХ ЗАХВОРЮВАНЬ І СИНДРОМІВ
Ведення хворих з ФП при гострому інфаркті міокарда
Показані:
- Електрична кардіоверсія при тяжких гемодинамічних порушеннях чи вираженій ішемії.
- Внутрішньовенне призначення дігоксину або аміодарону для сповільнення
ЧСС і поліпшення функції ЛШ.
- Внутрішньовенні b-адреноблокатори для сповільнення ЧСС у хворих без порушення функції ЛШ, бронхоспастичних захворювань чи АВ блокади.
- Гепарин у випадках ФП при гострому інфаркті міокарда, коли немає протипоказань для призначення антикоагулянтів.
Протипоказані:
- Антиаритмічні препарати IС класу.
Ведення хворих з ФП на фоні гіпертрофічної чи дилятаційної кардіоміопатії
Показані:
- Корекція порушень гемодинаміки.
- Призначення пероральних антикоагулянтів (до рівня МНС 2-3, або ПТІ 50-60%) для профілактики розвитку тромбоемболії, так само як в інших хворих з високим ступенем ризику.
- Профілактична антиаритмічна терапія (переважно аміодарон, в окремих випадках дизопірамід при дилятаційній кардіоміопатії; аміодарон у поєднанні з дизопірамідом, дизопірамід разом з b-адреноблокаторами при гіпертрофічній кардіоміопатії).
Ведення хворих з ФП при дисфункцiї щитовидної залози
Показані:
- Корекція дисфункції щитовидної залози. Синусовий ритм спонтанно відновлюється приблизно в 60% хворих через кілька тижнів після нормалізації функції щитовидної залози.
- Призначення b-адреноблокаторів, коли необхідно зменшити ЧСС і за відсутності протипоказань.
- При протипоказаннях для призначення b-адреноблокаторів для контролю ЧСС
необхідно використовувати антагоністи кальцію дилтіазем або верапаміл.
- Для запобігання тромбоемболії - пероральні антикоагулянти (до рівня МНС 2-3, ПТІ 50-60%), як і в хворих ФП з іншими факторами ризику інсульту. З непрямих антикоагулянтів перевагу надають варфарину.
Протипоказане:
- Невідкладне і профілактичне призначення аміодарону при будь-яких формах дисфункції щитовидної залози.
Ведення хворих з поєднанням ФП i передчасного збудження шлуночкiв
Показані:
- Катетерна абляція додаткових шляхів у симптомних хворих з синкопальними станами внаслідок високої ЧСС чи в хворих з коротким рефрактерним періодом додаткових шляхів проведення імпульсів.
- Невідкладна електрична кардіоверсія для запобігання фібриляції шлуночків при синдромі передчасного збудження шлуночків з високою ЧСС, що може спричинити гемодинамічну нестабільність.
-
Внутрішньовенно новокаїнамід для відновлення синусового ритму при синдромі передчасного збудження шлуночків і ФП з широкими (>120 мс) комлексами QRS на ЕКГ без порушення гемодинаміки.
Протипоказане:
- Внутрішньовенне призначення b-адреноблокаторів, дігоксину, дилтіазему або верапамілу у хворих з синдромом WPW і передчасним збудженням шлуночків.
Ведення хворих з ФП i легеневими захворюваннями
Показані:
- При гострих легеневих захворюваннях чи загостренні хронічних легеневих захворювань первинне завдання - корекція гіпоксії та ацидозу.
- При обструктивних захворюваннях легень для сповільнення ЧСС антагоністи кальцію (дилтіазем або верапаміл).
- Електрична кардіоверсія - при порушеннях гемодинаміки.
Протипоказані:
- Теофілін і b-адреноміметики у хворих з бронхоспазмом.
- b-адреноблокатори, соталол, пропафенон і аденозин у хворих з обструктивними захворюваннями легень.
Рекомендації з профілактики
післяопераційної ФП
Показані:
- Призначення b-адреноблокаторів для профілактики ФП за відсутності протипоказань.
- При виникненні ФП - контроль ЧСС та відновлення синусового ритму препаратами, які впливають на АВ провідність.
- Аміодарон або соталол для профілактики пароксизмів ФП у хворих з підвищеним ризиком розвитку ФП.
- Антитромботична терапія у випадку розвитку пароксизму ФП, так само як у хворих, яким не здійснюється хірургічне лікування.
Ведення хворих з ФП під час вагітності
Показані:
- Контроль ЧСС дігоксином, b-адреноблокаторами або антагоністами кальцію (залежно від терміну вагітності).
- Електрична кардіоверсія при порушеннях гемодинаміки.
- Антитромботична терапія (антикоагулянтами або аспірином) усім пацієнтам з постійною формою ФП, крім пацієнтів з "ізольованою" ФП.
ЗАКЛЮЧЕННЯ
Фундаментом доктрини оптимального індивідуалізованого ведення пацієнтів з фібриляцією передсердь і тріпотінням передсердь є ряд критеріїв, що відображають механізми запуску та особливості клінічної картини і узагальнені в сучасній класифікації ФП.
Основою припинення та профілактики пароксизмів ФП і ТП, а також запобігання тромбоемболічним ускладненням залишається медикаментозна терапія, яка включає антиаритмічні та антитромботичні засоби. Вагомою альтернативою тривалій антиаритмiчнiй терапії у пацієнтів з ТП є катетерна радіочастотна абляція, яка дає
змогу радикально усунути порушення ритму в більшості хворих. Впровадження в Україні сучасних рекомендацій з лікування фібриляції та тріпотіння передсердь вимагає відповідної корекції системи надання допомоги аритмологічним хворим в умовах стаціонару та поліклініки.
Перелік умовних скорочень
АВ атріовентрикулярний;
АЧТЧ активований частковий тромбопластиновий час;
ВСР варіабельність серцевого ритму;
ЕКГ електрокардіографія;
ЕКС електрокардіостимуляція;
ЕРП ефективний рефрактерний період;
ЕхоКГ ехокардіографія;
ІМ інфаркт міокарда;
ІХС ішемічна хвороба серця;
КРА катетерна радіочастотна абляція;
КЧВФСВ коригований час відновлення функції синусового вузла;
ЛШ лівий шлуночок;
МНС міжнародне нормалізаційне співвідношення;
НПВ нижня порожниста вена;
ПТІ протромбіновий індекс;
ПШ правий шлуночок;
ТК тристулковий клапан;
ТП тріпотіння передсердь;
СВ синусовий вузол;
ФП фібриляція передсердь;
ФВ ЛШ - фракція викиду лівого шлуночка;
ЧВФСВ час відновлення функції синусового вузла;
ЧСАП час синоатріального проведення;
ЧСС частота серцевих скорочень;
ЧШС частота шлуночкових скорочень.
Автори-укладачі
Рекомендації розробили члени Робочої групи з порушень серцевого ритму Українського наукового товариства кардіологів:
професор О.С. Сичов (Київ) - модератор, член-кореспондент НАН та АМН України, професор В.О. Бобров (Київ), професор О.Й. Жарінов (Київ), к.м.н. Ю.І. Карпенко (Одеса), академік АМН та член-кореспондент НАН України, професор О.В. Коркушко (Київ), д.м.н. С.Л. Локшин (Дніпропетровськ), професор О.І. Мітченко (Київ), к.м.н. Г.М. Солов'ян (Київ), д.м.н. О.С. Стичинський (Київ), к.м.н. О.І. Фролов (Київ).
В підготовці рекомендацій також прийняли участь незалежні експерти:
д.м.н. О.В. Боброва (Київ), професор Л.Г. Воронков (Київ), к.м.н. С.І. Деяк (Київ), академік АМН України, професор Г.В. Дзяк (Дніпропетровськ), к.м.н. В.Г. Дзяк (Дніпропетровськ), професор В.М.
Коваленко (Київ), професор М.І. Лутай (Київ), професор О.М. Пархоменко (Київ), професор Н.М. Середюк (Івано-Франківськ), професор Ю.М. Сіренко (Київ), професор В.К. Тащук (Чернівці), к.м.н. В.М. Чубучний (Київ), професор В.О. Шумаков (Київ), професор М.І. Яблучанський (Харьків), к.м.н. А.В. Ягенський (Луцьк).
Технічний секретар - к.м.н. Т.В. Гетьман (Київ).
Рекомендації обговорені на засіданні Круглого столу "Фібриляція та тріпотіння передсердь: тактика ведення хворих (обговорення проекту рекомендацій Українського наукового товариства кардіологів)" 18 квітня 2002 року, м. Київ.
Medicus Amicus 2002, #6
Medicus Amicus 2003, #1
Medicus Amicus 2003, #2
Medicus Amicus 2003, #3
Medicus Amicus 2003, #4
|
|
|
|
|
|

|  Новости Новости
| « Январь ´24 » |
| П | В | С | Ч | П | С | В | | 1 | 2 | 3 | 4 | 5 | 6 | 7 | | 8 | 9 | 10 | 11 | 12 | 13 | 14 | | 15 | 16 | 17 | 18 | 19 | 20 | 21 | | 22 | 23 | 24 | 25 | 26 | 27 | 28 | | 29 | 30 | 31 | |
01/01/15 - Уважаемые коллеги! От всей души поздравляем с Новым 2015 годом! Крепкого здоровья, успехов в профессиональной деятельности и простого Вам человеческого счастья! 02/01/15 - Разделы сайта пополнены новыми статьями 10/01/15 - Разделы сайта пополнены новыми статьями 20/01/15 - Разделы сайта пополнены новыми статьями 26/01/15 - Разделы сайта пополнены новыми статьями |
|









 Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог..
Пожилой возраст является фактором риска при раке молочной железы (РМЖ). Большая часть смертей от РМЖ происходит именно у пожилых. Не всегда у них удается провести лечение сог.. включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн..
включала всех живорожденных детей, а также случаи мертворождения и прерывания беременности вследствие врожденных пороков в 7 канадских провинциях за период 1993 по 2002 гг. Основн.. Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп..
Роль антитромботической терапии при хронической сердечной недостаточности (ХСН) у пациентов с синусовым ритмом обсуждается много лет. В частности, оживленные дискуссии вызывает воп.. Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас..
Жаропонижающие лекарственные средства - препараты, наиболее часто используемые для лечения детей как педиатрами, так и родителями. Этому способствуют бытующие представления об опас.. Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..
Неонатальный сепсис (НС) остается ведущей причиной смерти у недоношенных новорождённых. Стратегии для уменьшения частоты НС по-прежнему не достаточно эффективны, и связанная с НС с..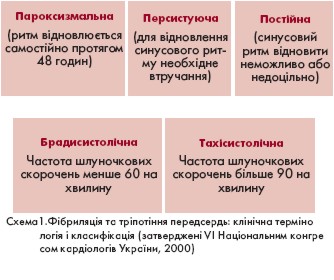





 Новости
Новости 