Вакцинация при атеросклерозе
Абдуева Ф.М., ассистент кафедры внутренних болезней Харьковского национального университета им. В.Н. Каразина
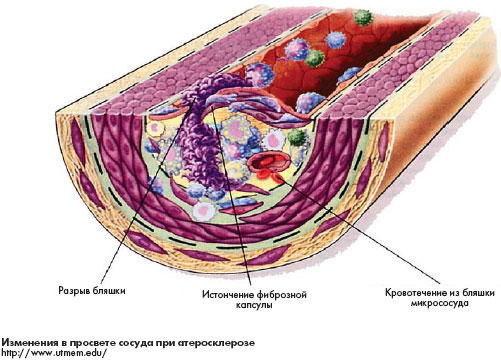
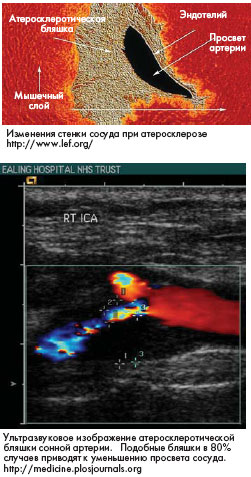
Общепризнанно, что атеросклероз является мультифакторным заболеванием со сложным патогенезом. Богатый
экспериментальный материал, накопленный в течение последних десятилетий, дает основание некоторым исследователям говорить о не просто воспалительной, но инфекционно-аутоиммунно-воспалительной теории его патогенеза. В соответствии с последней, атерогенез является следствием неадекватного ответа на различные формы повреждения, индуцированные инфекциями, турбулентностью и другими гемодинамическими стрессами, а также проатерогенными аутоантигенами.
Аутоиммунный механизм развития атеросклероза последнее время вызывает пристальный интерес на Западе, хотя сами эти представления не являются новыми. Аутоиммунный механизм разрабатывался еще в 70-х годах прошлого столетия советскими учеными под руководством
академика А.Н. Климова. Названия некоторых из его работ говорят сами за себя: "Иммунобиохимические механизмы развития атеросклероза" (1974), "Иммунореактивность и атеросклероз" (1986), "Аутоиммунная теория патогенеза атеросклероза" (1987), "Аутоиммунная теория атерогенеза и концепция модифицированных липопротеидов" (1990), "On the participation of lipoprotein-antibody immune complexes in atherogenesis" (1991).
Благодаря интернациональным усилиям происходит прогресс в понимании механизмов рекрутирования, дифференциации и активации иммунных клеток при атеросклерозе. Стенка сосуда находится под таким же иммунным надзором, как и другие ткани. Выявляемые в здоровых артериях у детей и подростков предсуществующие мононуклеарные инфильтрации в наиболее предрасположенных к атеросклерозу сосудистых участках (например, бифуркации) называют ассоциированной с сосудами лимфоидной тканью (АСЛТ), по аналогии с ассоциированной со слизистой лимфоидной
тканью. Предполагается, что АСЛТ имеет сходную функцию, как локальная система иммунонадзора, мониторирующая появление в крови потенциально опасных эндогенных или экзогенных антигенов. Было идентифицировано несколько атеросклероз-ассоциированных аутоантигенов, включая окисленные липопротеиды низкой плотности, белки теплового шока, кардиолипин, бета2-гликопротеин-1. Кроме аутоантигенов в атерогенез, как в воспалительный процесс
, вовлечены различные семейства молекул воспаления, такие как интегрины, селектины, клеточные рецепторы, белки острой фазы воспаления и, безусловно, цитокины. Сложность патофизиологии иммунного ответа при атеросклерозе состоит в том, что одни и те же цитокины, например интерлейкины, могут оказывать прямо противоположные эффекты: проатерогенный и атеропротекторный. Баланс между провоспалительными и противовоспалительными цитокинами и другими
молекулярными участниками воспаления может быть решающим для прогрессирования атеросклероза. Провоспалительными и, следовательно, проатерогенными считаются: С-реактивный белок, E-селектин, эндотоксин, фактор некроза опухоли (ФНО-g), интерлейкины (IL-1b, IL-8, Il-12, Il-18), CD40-CD154, макрофагальный хемоаттрактантный протеин, лейкотриен P4, продукты деградации липоксигеназы. Противовоспалительными/атеропротекторными являются: IL-4, Il-10, TGF b (transforming growth factor) и PD6 (platelet-derived growth factor) и другие.
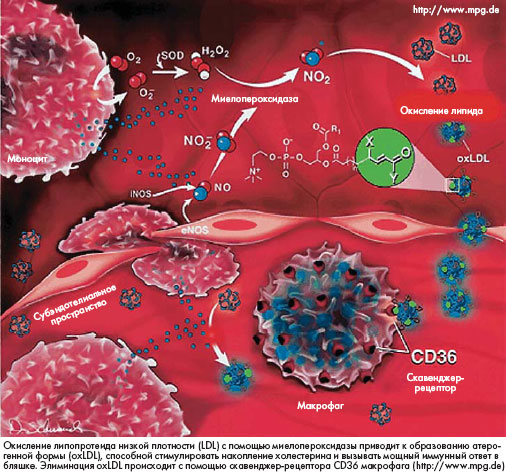
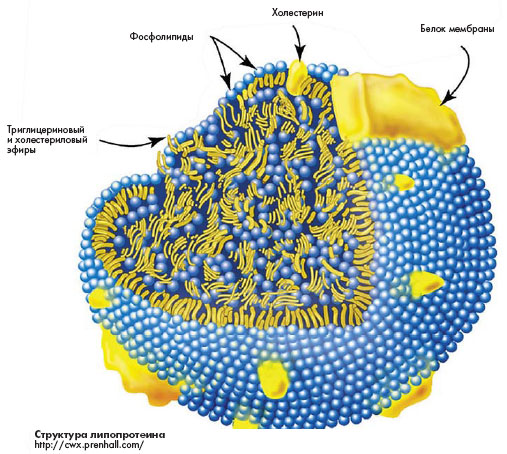
Наиболее выраженными атерогенными свойствами обладают модифицированные липопротеиды (окисленные, гликозилированные). Окисленные липопротеиды низкой плотности (oxLDL - в английской транскрипции) являются аутоантигенами, индуцирующими сильный локальный
иммунный ответ в бляшке, и многие Т-клетки, инфильтрирующие бляшку, являются специфически активированными против oxLDL. Кроме того, oxLDL могут стимулировать апоптоз, участвующий в процессах дестабилизации бляшки. В организме существуют налаженные механизмы элиминации oxLDL путем их связывания со скавенджер-рецепторами ("мусорщиками") макрофагов и фагоцитоза, а также связывание антителами. Концентрация oxLDL значительно выше у пациентов
с ишемической болезнью сердца, чем в группе контроля. Однако наличие oxLDL не имеет достоверной корреляции с такими главными факторами риска ИБС, как гиперлипидемия, гипертензия, курение и диабет. Это означает, что элиминация этих факторов риска не обязательно повлияет на уровни oxLDL. Поэтому остается актуальным поиск средств воздействия на крайне атерогенные модифицированные липопротеиды, в частности на oxLDL.
Другими не менее значимыми в атерогенезе являются белки теплового шока. Белки теплового шока (HSP в английской транскрипции) или шапероны, являются цитопротекторами, способствуя правильным конформационным укладкам нативных или денатурированных белков. HSP участвуют в патогенезе всех конформационных (прионовых) заболеваний, амилоидозе, старении, болезней соединительной ткани и сердечно-сосудистой системы. Многочисленными исследованиями была продемонстрирована связь между повышением в крови уровня белков теплового шока и наличием
сердечно-сосудистых заболеваний (ССЗ), включая атеросклероз, а также между наличием антител к белкам теплового шока и тяжестью ССЗ. HSP синтезируются в повышенных количествах в ответ на эндотелиальный стресс любой этиологии: инфекционной, механической, токсической и др. Наиболее значимым в патогенезе атеросклероза считают HSP60. Этот представитель семейства HSP является не менее важным атеросклероз-ассоциированным аутоантигеном, чем oxLDL.
HSP60 обнаруживается непосредственно в атеросклеротической бляшке, индуцируя и поддерживая локальную иммуновоспалительную реакцию. Эндотелиальные клетки и клетки атеросклеротической бляшки являются первыми потенциальными мишенями для циркулирующих HSP60-специфичных Т-клеток или антител. Особо следует отметить
возможность секреции HSP Chlamydia pneumoniae и другими патогенами. В связи с этим выдвигается гипотеза антигенной мимикрии, когда в результате появления специфических антител к хламидийным HSP происходит перекрестное реагирование с собственными гомологичными HSP, т.е. возникает аутоиммунная реакция. Таким образом, иммунитет против HSP проатерогенный, а против LDL - защитный.
Аутоиммунно-воспалительная теория патогенеза атеросклероза развилась в новый, привлекательный и многообещающий подход к его лечению и профилактике - иммуномодуляцию. Это новая стратегия, состоящая в подавлении проатерогенных и активации атеропротекторных иммунных факторов.
Идея иммуномодуляции, как и сама аутоиммунная теория, не является новаторской. Так, к примеру, академик А.Н. Климов предложил несколько методов лечения атеросклероза, основанных на принципе иммуномодуляции, в частности, применение препаратов тимуса. Однако недавно на американском кардиологическом сайте в Интернет появилось несколько сенсационное сообщение о перспективе создания противоатеросклеротической вакцины.
Современная медицинская научная мысль разрушила традиционный стереотип о вакцинации как о методе профилактики лишь инфекционных заболеваний. Клинические испытания проходят вакцины против болезни Альцгеймера, ревматоидного артрита, диабета I типа, а также
различные виды противораковых вакцин. Принцип действия последних основан на придании свойства иммуногенности собственным раковым клеткам пациента путем добавления различных адъювантов или переноса генов, кодирующих костимулирующие молекулы. В ведущих лабораториях мира идут попытки применить аналогичный подход к лечению и профилактике атеросклероза.
Основной терапевтической мишенью для вакцинации является oxLDL и его апопротеин В-100. Вакцинация животных oxLDL, окисленными in vitro, неожиданно продемонстрировала защитный эффект. Выяснилось, что появление IgM и IgG, синтезирующихся против oxLDL в процессе
иммунизации у подопытных животных, приводит к снижению атерогенеза. Еще необходимо выяснить, оказывают ли антитела против oxLDL, синтезированные естественным образом, а не индуцированные иммунизацией, атеропротекторный эффект. Ответ на этот вопрос открывает возможность вакцинации у людей. Вакцинация мышей против особого эпитопа апопротеина В-100, представленного в LDL, снижала аортальный атеросклероз на 40% и воспаление бляшки на 80%.
В силу того, что иммунитет против HSP60 является проатерогенным, вакцинация подопытных животных этим протеином приводила к появлению липидных полосок, утолщению интимы сосудов и прогрессированию атеросклероза. Возможной терапевтической стратегией в данном случае будет являться блокирование собственных антител к HSP60.
Другими мишенями вакцинации при атеросклерозе являются цитокины и среди них IL-12. Последний является ключевым активатором цитокинового ответа Т - хелперов 1-го типа, доминирующих в клеточном пуле Т-хелперов, инфильтрирующих атеросклеротическую бляшку. Экспериментальные результаты селективной блокады проатерогенного IL-12, путем вакцинации у мышей, показали существенное (на 68,5%)
снижение атерогенеза и повышение стабильности атеросклеротической бляшки.
Безусловно, модулирование иммунной системы при комплексных заболеваниях не может обходиться без рисков, но, учитывая медико-социальное значение атеросклероза, ожидаемый положительный эффект превосходит риски. Существующие экспериментальные данные свидетельствуют о снижении развития атеросклероза на 50-60%.
Активная иммунизация или вакцинация при атеросклерозе не может полностью предотвратить развитие заболевания. Однако появление эффективной вакцины является клинически востребованным и послужит необходимым дополнением к общепризнанным методам лечения, которыми являются статины, риск-модифицирующие и интервенционные вмешательства.
Рекомендуемая литература:
1. А.Н. Орехов, Писаржевский С.А. Инфекционно-аутоиммунно-воспалительная гипотеза патогенеза атеросклероза. Институт атеросклероза РАЕН. www.cardiosite.ru
Prediman K. Shah, M.D., F.A.C.C.Immunization for Atherosclerosis Transcatheter Cardiovascular Therapeutics TCT 2005.
2. Hansson GK. Inflammation, atherosclerosis, and coronary artery disease. N Engl J Med 2005; 352: 1685-9.
3. Andrie R, Braun P, Welsch U, Straube E, Hopp HW, Erdmann E, Luderitz B, Bauriedel G. Chlamydial and human heat shock protein 60 homologues in acute coronary syndromes. (Autoimmune reactions as a link between infection and atherosclerosis. Z Kardiol. 2003 Jun;92(6):455-65.
4. Gupta M, Vavasis C, Frishman WH.Heat shock proteins in cardiovascular disease a new therapeutic target. Cardiol Rev. 2004 Jan-Feb;12(1):26-30.
5. Millonig G, Schwentner C, Mueller P, Mayerl C, Wick G. The vascular-associated lymphoid tissue: a new site of local immunity. Curr Opin Lipidol. 2001 Oct;12(5):547-53.
Medicus Amicus #2, 2006
|















 Новости
Новости 